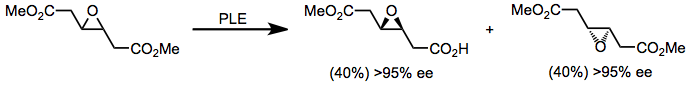Hidrólise assimétrica de éster com esterase de fígado de porco - Asymmetric ester hydrolysis with pig-liver esterase
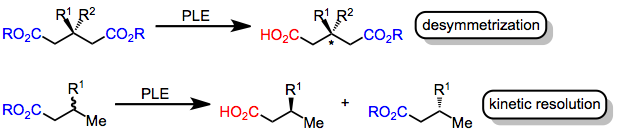
A hidrólise assimétrica do éster com esterase de fígado de porco é a conversão enantiosseletiva de um éster em um ácido carboxílico por meio da ação da enzima esterase de fígado de porco (EC 3.1.1.1). A hidrólise assimétrica do éster envolve a reação seletiva de um de um par de grupos éster enantiotópicos (dentro da mesma molécula e relacionados por um plano de simetria da molécula) ou enantiomórficos (em moléculas enantioméricas e relacionados como imagens de espelho).
Introdução
As enzimas, que são compostas de aminoácidos quirais , catalisam reações químicas com alta estereosseletividade . Especificamente, as enzimas esterase catalisam a hidrólise de ésteres em ácidos carboxílicos . Esta transformação pode ser tornada assimétrica se dois grupos de éster enantiotópico existirem no substrato ou se uma mistura racêmica de ésteres quirais for usada. No primeiro caso ( desimetrização ), o ambiente quiral do sítio ativo da enzima leva à hidrólise seletiva do éster que está mais próximo do resíduo de serina cataliticamente ativo quando o substrato está ligado à enzima. No último caso ( resolução cinética ), um dos enantiômeros é hidrolisado mais rápido do que o outro, levando a um excesso de produto hidrolisado de um enantiômero. Ambas as estratégias baseiam-se no fato de que os estados de transição para hidrólise de grupos éster enantiotópico ou enantiomórfico pela enzima quiral são diastereoméricos .
A esterase de fígado de porco (PLE) é uma enzima amplamente usada para hidrólise de éster assimétrica. Embora tenha sido originalmente usado para a hidrólise desimetrizante de ésteres de glutarato, o PLE também hidrolisa malonatos , diésteres cíclicos, monoésteres e outros substratos. Modelos de sites ativos foram avançados para explicar a seletividade do PLE.
(1)
Mecanismo e estereoquímica
Mecanismo Prevalecente
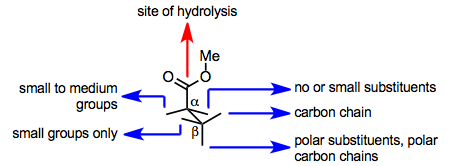
O sítio ativo do PLE facilita tanto a ligação ao substrato quanto a hidrólise. Um resíduo chave de serina no sítio ativo promove a hidrólise, mas o substrato deve apresentar um grupo éster a esse resíduo após a ligação ao sítio ativo da enzima para que a hidrólise ocorra. Se o substrato é capaz de apresentar um grupo éster ao resíduo de serina catalítica depende de sua conformação ligada no sítio ativo, que é ditada pelas cadeias laterais de aminoácidos no sítio ativo. Assim, os modelos de sítio ativo de PLE foram avançados com o objetivo de prever a partir da estrutura do substrato qual dos dois grupos éster enantiotópico será hidrolisado (ou se a hidrólise é provável que ocorra).
Um modelo simples para a conformação de ligação de um éster no sítio ativo de PLE é mostrado abaixo. Este modelo prevê com precisão a configuração de glutaratos hidrolisados e substratos semelhantes.
(2)
Escopo e limitações
Embora o escopo do substrato de PLE seja amplo, a enantiosseletividade varia em função da estrutura do substrato. Esta seção descreve substratos que são hidrolisados por PLE com a maior enantioseletividade, bem como substratos sensíveis que podem ser hidrolisados em ácidos carboxílicos aquirais em alto rendimento sem reações colaterais.
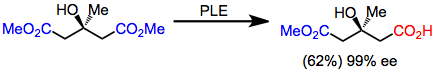
Os glutaratos foram os primeiros substratos a serem hidrolisados com PLE em alta enantiosseletividade. Embora os rendimentos sejam moderados, a enantiosseletividade é extremamente alta.
(3)
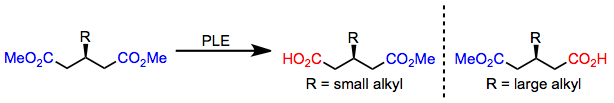
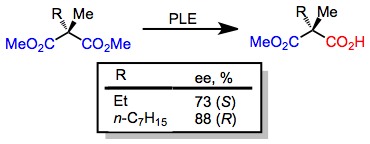
Glutaratos de 3-alquil com substituintes de alquil pequenos são hidrolisados no ( R ) -monoéster; no entanto, quando um substituinte alquil grande está presente, o ( S ) -monoéster se forma. Esta mudança na enantiosseletividade é prevista com precisão pelo modelo de sítio ativo fornecido acima.
(4)
Uma tendência oposta é observada na desimetrização de hidrólises de 2-metil malonatos , que fornecem o enantiômero ( S ) quando o outro substituinte em C-2 é pequeno, e o enantiômero ( R ) quando o outro substituinte C-2 é grande.
(5)
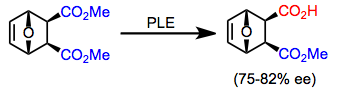
Vários meso diésteres diferentes dos substratos descritos acima podem ser hidrolisados por PLE com alta enantiosseletividade. Os meso diésteres cíclicos tendem a ser hidrolisados mais seletivamente do que os diésteres acíclicos. O enantiômero predominante do produto depende do tamanho do anel.
(6)
7-oxabiciclo [2.2.1] heptano-2,3-dicarboxilatos são uma classe interessante de diésteres que são hidrolisados por PLE com alta enantiosseletividade. Esses substratos têm sido usados para a construção enantiosseletiva de açúcares biologicamente relevantes (ver Aplicações Sintéticas abaixo).
(7)
Misturas racêmicas de todos os substratos descritos acima, bem como diésteres quirais adicionais (tais como o éster epóxi na equação (8)), podem ser resolvidas usando PLE para resolução cinética. Uma desvantagem significativa da resolução cinética é um rendimento máximo do produto hidrolisado de 50%. No entanto, se a racemização rápida estiver ocorrendo junto com a hidrólise (um exemplo de resolução cinética dinâmica ), um rendimento máximo de 100% é possível.
(8)
As enzimas esterases também podem ser utilizadas para a hidrólise de monoésteres sensíveis a bases. O PLE foi aplicado à síntese de prostaglandinas para a hidrólise seletiva do éster sem destruição da porção β-hidroxicetona.
(9)
Aplicações Sintéticas
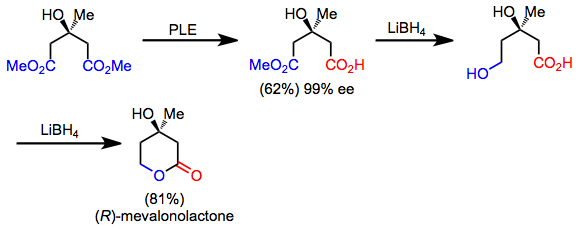
Vários alvos sintéticos possuem simetria oculta que pode ser descoberta aplicando uma transformação de "simetrização" retrosintética. Na direção para frente, esta operação corresponde a uma reação de desimetrização. Por exemplo, a mevalonolactona pode ser sintetizada rapidamente a partir de um diéster simétrico por meio de hidrólise por dessimetrização, redução quimiosseletiva e lactonização. Embora o produto em si seja assimétrico, a desimetrização e as manipulações de grupos funcionais permitem sua síntese a partir de um material de partida aquiral.
(10)
A hidrólise enantiosseletiva de um diéster conjugado seguida por ozonólise fornece o esqueleto da ribose. Os açúcares resultantes são então transportados para a síntese de nucleosídeos.
(11)
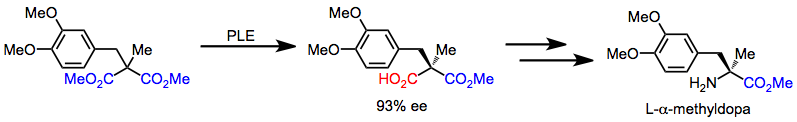
A L-α-metildopa pode ser rapidamente sintetizada a partir de um malonato aquiral por meio de uma sequência que começa com a desimetrização. As transformações quimiosseletivas subsequentes convertem o ácido carboxílico em uma amina.
(12)
Comparação com outros métodos
Outras enzimas que podem ser usadas para hidrólise de éster assimétrica incluem acetilcolinesterase de enguia elétrica, quimotripsina e levedura de padeiro . O escopo do substrato dessas enzimas difere do PLE e, em alguns casos, elas podem fornecer produtos hidrolisados com maior rendimento ou enantiosseletividade do que o PLE. Os microrganismos também podem ser usados para hidrólise enantiosseletiva; no entanto, as dificuldades associadas ao manuseio de microrganismos tornaram esses métodos impopulares para a síntese orgânica.
Os métodos não enzimáticos para a diferenciação de grupos enantiotópicos empregam catalisadores quirais ou auxiliares. Por exemplo, a introdução de um grupo de saída quiral em ambos os grupos de ácido carboxílico de um meso diácido leva a um ataque seletivo por um nucleófilo aquiral em um dos (agora) grupos carbonila diastereotópicos.
(13)
Condições Experimentais e Procedimento
Condições Típicas
As reações enzimáticas são limitadas pela necessidade de solvente aquoso e condições de reação quase neutras. As hidrólises de PLE são tipicamente realizadas com um tampão de fosfato para manter o pH entre 7 e 8. Como a solubilidade do substrato no meio aquoso é crítica, uma pequena quantidade de um co-solvente orgânico polar é às vezes adicionada à solução aquosa do enzima. O PLE disponível comercialmente é de pureza suficiente para a maioria das aplicações.