Isoforma épsilon da caseína quinase 1 - Casein kinase 1 isoform epsilon
Isoforma epsilon da caseína quinase I ou CK1ε, é uma enzima que é codificada pelo gene CSNK1E em humanos. É o homólogo mamífero do tempo duplo . CK1ε é uma proteína quinase serina / treonina e é altamente conservada; portanto, esta quinase é muito semelhante a outros membros da família da caseína quinase 1 , da qual existem sete isoformas de mamíferos (α, β, γ1, γ2, γ3, δ e ε). CK1ε é mais semelhante a CK1δ em estrutura e função, pois as duas enzimas mantêm uma alta similaridade de sequência em seus domínios reguladores C-terminal e catalítico . Este gene é o principal componente do oscilador dos mamíferos, que controla os ritmos circadianos celulares . CK1ε também foi implicado na modulação de vários problemas de saúde humana, como câncer, doenças neurodegenerativas e diabetes.
Descoberta
Mutação CK1ε-tau
Em hamsters, a mutação CK1ε-tau foi descoberta pela primeira vez por Michael Menaker e Martin Ralph em 1988, enquanto estudava uma remessa de laboratório de hamsters sírios . Eles observaram um hamster com um período circadiano anormal e, após reprodução e posterior caracterização, os dois perceberam que a mutação em hamsters conferia um período de corrida livre mais curto do que o normal . Eles atribuíram esse fenótipo ao que chamaram de “mutação tau”, que foi a primeira descrição completa de um mutante circadiano de mamífero. Esta descoberta forneceu uma ferramenta para outros cientistas realizarem pesquisas sobre relógios biológicos e foi um importante desenvolvimento inicial no campo.
Clonado CK1ε Humano
Em 1995, a forma humana de CK1ε foi isolada e clonada pela primeira vez pelo laboratório Virshup na Universidade de Utah. Foi oficialmente identificado como uma isoforma da família da caseína quinase 1. Três variantes de transcrição que codificam a mesma proteína foram encontradas para este gene em ratos: CK1ε1, CK1ε2 e CK1ε3; e dois foram encontrados em humanos.
Mapeamento Genético
Em 2000, o gene CK1ε foi posteriormente mapeado e identificado por Joseph Takahashi e colegas, que, usando a análise de diferença representacional geneticamente direcionada, descobriram que a mutação tau estava localizada no gene CK1ε. O gene CK1ε foi encontrado para ser semelhante ao gene de tempo duplo em Drosophila , que foi caracterizado e incorporado na função do relógio biológico por Michael Young e colegas em 1998. Em humanos, o gene CSNK1E se localiza em 22q13.1 e consiste em 12 exons .
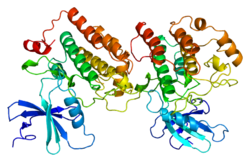
Imagem Estrutural
A imagem estrutural foi realizada de CK1ε em 2012 por Alexander Long e colegas usando cristalografia de raios-X . Certos motivos estruturais relacionados à quinase foram subsequentemente confirmados, como um motivo de fita β-volta-fita β que ancora ATP, um motivo DFG que orienta os fosfatos de ATP, uma alça catalítica que se assemelha àquela de PKA e os principais locais de reconhecimento de substrato em o domínio C-terminal.
Estrutura
As estruturas tridimensionais dos domínios catalíticos dos mamíferos CK1δ e CK1ε foram resolvidas pela primeira vez por cristalografia de raios-X em 1996 e 2012, respectivamente. CK1 quinase tem múltiplas isoformas, incluindo um total de sete isoformas caracterizadas em mamíferos (alfa, beta, gama1-3, delta e épsilon. As diferentes isoformas diferem principalmente no comprimento e estrutura de sua região não catalítica C-terminal. as isoformas delta e épsilon demonstraram desempenhar um papel importante na regulação do ritmo circadiano.
CK1δ e CK1ε compartilham um padrão altamente semelhante em suas estruturas. A alça P rica em glicina está entre as fitas β1 e β2, formando um motivo clássico de fita β-volta-fita β que ancora e fixa o alfa fosfato de ATP. CK1δ / ε adicionalmente compartilham características conservadas dentro do domínio catalítico , que são compostas por um lóbulo N-terminal e um lóbulo α-helicoidal C-terminal. O centro catalítico está localizado na região da fenda entre os dois lobos, que também se associa ao nucleotídeo e ao substrato. Todos os inibidores conhecidos ligam-se a este centro, bloqueando a ligação do ATP.
Função
Função enzimática
A proteína codificada pelo gene epsilon da caseína quinase 1 é uma proteína quinase serina / treonina e um membro da família da proteína caseína quinase I, cujos membros têm sido implicados no controle de processos citoplasmáticos e nucleares , incluindo replicação e reparo de DNA . Como outros membros da família de proteínas da caseína quinase 1, a caseína quinase 1 epsilon reconhece o motivo Ser (p) XXSer / Thr para fosforilação . É encontrado no citoplasma como um monômero e pode fosforilar uma variedade de proteínas, incluindo a si mesmo. Esta autofosforilação ocorre no domínio C-Terminal da proteína , uma região que se acredita se comportar como um pseudo - substrato , e inibe a atividade da quinase.
O relógio circadiano
A proteína epsilon da caseína quinase 1 é parte do oscilador de mamífero , um grupo de proteínas que mantém as células em uma programação de aproximadamente 24 horas. Este oscilador, ou "relógio circadiano", é composto de um ciclo de feedback de transcrição-tradução (TTFL) no qual várias proteínas trabalham em conjunto, cada uma regulando a expressão das outras para gerar um ciclo de aproximadamente 24 horas de níveis de mRNA e proteínas . O TTFL também gera ritmos de produção de aproximadamente 24 horas, como níveis de liberação de hormônio celular. As oscilações diárias na transcrição de proteínas e mRNA foram observadas em muitas células, incluindo o relógio mestre dos mamíferos conhecido como núcleo supraquiasmático (SCN). No entanto, ao contrário da maioria das proteínas do ritmo circadiano que oscilam em sua expressão, a caseína quinase 1 épsilon é constitutivamente ativa.
As proteínas do núcleo que compreendem o TTFL de mamífero incluem Período (PER), Criptocromo (CRY), BMAL1 , RELÓGIO e caseína quinase 1 epsilon. BMAL1 e CLOCK trabalham para aumentar a transcrição de PER e CRY formando um heterodímero e ligando -se ao domínio E-box a montante das sequências de codificação dos genes PER e CRY. Os níveis de PER e CRY são regulados por feedback negativo, o que significa que reprimem sua própria transcrição. A fosforilação de proteínas PER por CK1ε tanto no citoplasma quanto no núcleo marca essas proteínas para degradação. A fosforilação também prejudica a capacidade do PER de entrar no núcleo, induzindo uma mudança conformacional em sua sequência de localização nuclear . Por outro lado, o complexo proteico FBXL3 medeia a degradação das proteínas CRY no citoplasma e no núcleo. Se o CRY se liga ao PER antes de ser fosforilado pelo CK1ε, essas três proteínas se estabilizam em um complexo que pode entrar no núcleo. Uma vez dentro do núcleo, PER e CRY trabalham para inibir sua própria transcrição, enquanto a caseína quinase 1 épsilon trabalha para modular a atividade de BMAL1 e CLOCK por meio da fosforilação.
Como afirmado anteriormente, o domínio C-Terminal da caseína quinase 1 epsilon se comporta como um pseudo-substrato quando fosforilado, inibindo a atividade da quinase. O domínio C-Terminal também demonstrou ser desfosforilado por fosfatases , como a proteína fosfatase 1 (PP1) in vitro e a cultura de células, que regula os níveis de caseína quinase ativa in vivo . A teoria atual dos ritmos circadianos levanta a hipótese de que este ciclo de fosforilação / desfosforilação da caseína quinase 1 épsilon é importante na modulação do período de ritmos circadianos na célula, com o aumento da fosforilação diminuindo a atividade da caseína quinase 1 epsilon (e subsequentemente aumentando o CRY e PER ativo) e desfosforilação de caseína quinase 1 epsilon resultando em uma quinase mais ativa (e níveis mais baixos de CRY e PER ativos).
Em camundongos, foi demonstrado que a caseína quinase 1 epsilon fosforila tanto PER1 quanto PER2 , bem como CRY1 e CRY2 . A caseína quinase 1 resulta em uma expressão cíclica de proteínas osciladoras de mamíferos, resultando em um cronômetro (oscilador de mamíferos) para a célula:
| Nível de proteína | Resultado Imediato | Resultado Atrasado | |
|---|---|---|---|
| Amanhecer (7h) | baixa concentração de proteína PER e CRY | Per e Cry (gene) ativamente transcrito e estimulado pelos fatores de transcrição BMAL1 e CLOCK | N / D |
| Anoitecer (19h) | alta concentração de proteína PER e CRY | altos níveis de proteína PER e CRY reprimem a transcrição de Per e Cry (gene) | a caseína quinase 1 épsilon fosforila PER e CRY, marcando a proteína para degradação: a concentração de proteínas PER e CRY diminui |
Mutações na função circadiana
O fenótipo proeminente nos hamsters mutantes CK1ε tau descobertos por Menaker foi um período de execução livre incomumente curto - 22 horas em heterozigotos e 20 horas em homozigotos para a mutação - tornando este alelo semidominante . O gene CK1ε foi posteriormente mapeado e identificado por Joseph Takahashi e colegas, que revelou uma mutação de substituição C-para-T de um único par de bases no gene CK1ε do hamster. Este polimorfismo de nucleotídeo único (SNP) resulta em uma substituição de arginina por cisteína em uma região de domínio de reconhecimento de fosfato de CK1ε, uma região altamente conservada do gene em mamíferos. Atualmente, não está claro como exatamente a mutação CK1ε-tau resulta em um período de execução livre mais curto . No entanto, foi sugerido que a mutação tau é uma mutação de ganho de função, levando ao aumento da fosforilação de certos locais PER, aumentando assim a taxa de degradação de PER e encurtando o período circadiano. A mutação CK1ε-tau em hamsters foi a primeira descrição completa de um mutante circadiano mamífero.
Em humanos, as mutações que afetam o local de fosforilação PER2 do gene CK1ε e / ou CK1δ resultam na Síndrome da Fase do Sono Familiar Avançada (FASPS). Esta mutação, S662G, que resulta na perda de um único sítio aceitador de fosfato no PER2, impede a proteína CK1ε de se ligar ao PER e leva a um período circadiano anormalmente curto.
Além disso, uma mutação hereditária em CK1δ humano, T44A, foi identificada como outra mutação que causa o encurtamento do período e foi identificada como outro mecanismo que causa FASPS. Esta mutação reduz a atividade de CK1δ in vivo em humanos e, de forma semelhante, demonstrou fazer o mesmo em camundongos. No entanto, experimentos em outras espécies, como moscas, mostraram que essa mutação induz efeitos de prolongamento do período.
Além disso, em humanos, as mutações P415A e H417R em PER3 mostraram desestabilizar a proteína. Foi demonstrado que essas mutações geram FASPS e também estão associadas à regulação do humor prejudicada.
Compensação de temperatura
CK1δ / ε é compensado pela temperatura, uma característica de muitos ritmos circadianos. A capacidade do CK1δ / ε de fosforilar seus substratos permanece constante mesmo quando a temperatura flutua, enquanto as taxas de reação normais tendem a aumentar com o aumento da temperatura. Além disso, os mutantes CK1ε tau mostram uma perda de compensação de temperatura.
Homólogos não mamíferos
Dois homólogos funcionais de ritmo circadiano desta proteína de mamífero podem ser encontrados em Drosophila melanogaster (mosca da fruta). Homólogos funcionais referem-se a proteínas que compartilham uma função semelhante em outro animal, mas que não são necessariamente semelhantes geneticamente .
Um gene, que codifica a proteína Doubletime (abreviado dbt ), serve a um propósito semelhante à caseína quinase 1 épsilon na cronobiologia , pois desempenha um papel na fosforilação de PER . No entanto, sua sequência de genes não mostra homologia de sequência. Além disso, a caseína quinase 1 épsilon não resgata completamente os ritmos circadianos em nocautes de tempo duplo de mosca da fruta ( dbt - / - ), sugerindo que essas enzimas têm funções semelhantes, mas não idênticas.
Outro homólogo funcional, o gene da Drosophila para a glicogênio sintase quinase 3 (GSK3), denominado shaggy e abreviado sgg, codifica uma proteína que fosforila Timeless (TIM), o homólogo funcional CRY da mosca da fruta . Como o dbt , o shaggy não é uma sequência homóloga à caseína quinase 1 epsilon. Por outro lado, Gsk3 também é encontrado em mamíferos, e mutantes têm sido implicados em anormalidades do ritmo circadiano em pacientes que sofrem de transtorno bipolar .
O genoma de Drosophila melanogaster contém outras enzimas da família da caseína quinase 1, que se acredita não ter nenhuma função circadiana. No entanto, uma enzima da família da caseína-quinase diferente, a caseína-quinase 2 alfa, foi implicada no fornecimento da fosforilação inicial de um resíduo de serina que é reconhecido por DBT e Salsicha para fosforilação PER e TIM sequencial.
Importância de CK1δ
Embora CK1ε tenha sido tradicionalmente considerado o principal regulador da fosforilação PER e CRY , acredita-se que a isoforma delta de caseína quinase 1 ( CK1δ ou CSNK1D ), uma isoforma , desempenha um papel semelhante no TTFL. Ambos CK1ε e CK1δ fosforilam e desestabilizam PER in vitro, bem como interagem com PER e CRY in vivo. Além disso, foi demonstrado que CK1δ interage melhor com proteínas do relógio molecular da drosófila do que CK1ε, indicando que CK1δ pode ser mais homólogo a dbt do que CK1ε. Além disso, a espectrometria de massa mostrou que o CK1δ é mais de 20 vezes mais abundante do que o CK1ε no fígado.
Mecanismo de Phosphoswitch
Acredita-se que a fosforilação de PER2 seja regulada por um mecanismo de fosfato. Especificamente, PER2 requer uma fosforilação de priming inicial a fim de ser fosforilado e subsequentemente degradado por CK1δ e / ou CK1ε. Desta forma, as fosforilações sequenciadas temporalmente de PER2 agem para atrasar sua taxa de degradação e podem fornecer uma visão sobre como o relógio circadiano é compensado por temperatura. CK1δ e / ou CK1ε podem fornecer a atividade de iniciação. O site FASP em PER2 é um alvo chave desta atividade de priming quinase. Mutações neste local podem afetar a capacidade do PER2 de receber uma fosforilação inicial, levando a um aumento ou redução do período. Outros estudos sugeriram que a fosforilação a jusante de PER2 leva a interações de estabilização que diminuem a taxa de degradação de PER. Acredita-se que isso aumente o período do relógio circadiano. Acredita-se que mutações na área de fosforilação de PER2 estejam relacionadas a pacientes com FASPS
Outras funções
Caminho Wnt canônico
A via Wnt canônica envolve o acúmulo de β-catenina no citoplasma, que ativa os fatores de transcrição. A caseína quinase 1 epsilon e a caseína quinase 1 delta relacionada são desfosforiladas nesta via. A desfosforilação da caseína quinase 1 epsilon é provavelmente alcançada pela Proteína Fosfatase 2 (PP2A), que aumenta a atividade da quinase de ambas as enzimas in vivo. A caseína quinase 1 epsilon e a caseína quinase 1 delta têm sido implicadas no aumento da estabilidade da β-catenina no citoplasma, embora os estudos do mecanismo para esta estabilização sejam inconclusivos. A teoria atual de como a caseína quinase 1 epsilon e / ou caseína quinase 1 delta funcionam nesta via é que ambas as caseína quinases estabilizam diretamente a β-catenina por meio de regulação positiva ou indiretamente estabilizam a β-catenina por meio da regulação negativa da β- complexo de degradação da catenina ( protease ).
Câncer
A caseína quinase 1 epsilon e delta são conhecidos por fosforilar uma proteína supressora de tumor , p53 in vivo em humanos e murinos , ou ratos do velho mundo. CK1 fosforila p53 em seu N-terminal para induzir sua ativação, o que subsequentemente aumenta a parada do ciclo celular e a apoptose . Foi demonstrado que o dano ao DNA ativa o p53 por meio da ativação intensificada de CK1. A inativação de CK1 leva à diminuição da resistência à apoptose.
A caseína quinase 1 epsilon também está implicada como causador indireto do câncer por meio de sua regulação da proteína associada ao Yes (YAP), um oncogene e regulador do tamanho do órgão. Após o priming por fosforilação pela serina / treonina quinase LATS , tanto a caseína quinase 1 epsilon quanto a caseína quinase 1 delta mostraram fosforilar YAP e marcá-lo para ubiquitinação e degradação.
Vício
Vários estudos demonstraram uma conexão entre os componentes moleculares do relógio circadiano e transtornos psiquiátricos, particularmente o uso de drogas. Estudos de associação genética em humanos implicaram CK1ε / CK1δ no desenvolvimento de vícios em metanfetamina, heroína e álcool. Além disso, estudos em camundongos revelam uma ligação entre a atividade CK1ε / CK1δ e o efeito estimulante produzido pela metanfetamina. Além disso, a inibição de CK1ε / CK1δ em roedores demonstrou diminuir o comportamento de recaída do álcool e opiáceos durante a abstinência.
Interações
Foi demonstrado que a caseína quinase 1 epsilon interage com PER1 , PER2 , CRY1 , CRY2 , BMAL1 , CLOCK , NPAS2 e AXIN1 . PER1, PER2 e BMAL1 podem ser fosforilados diretamente por CK1ɛ, enquanto PER3, CRY1 e CRY2 só podem ser fosforilados por CK1ɛ quando associados a PER1 ou PER2.
Inibidores
Vários inibidores foram produzidos por empresas de biotecnologia para facilitar a pesquisa sobre a função da caseína quinase 1 epsilon. Testes utilizando inibidores de CK1ε confirmaram o envolvimento de CK1ε em uma variedade de processos, especialmente na regulação dos ritmos circadianos.
Pf-670462 e PF-4800567
PF-670462, desenvolvido pela Pfizer , é um inibidor bem caracterizado de CK1ε e CK1δ que demonstrou alongar o período de ritmos circadianos quando administrado in vitro a fibroblastos de rato e células COS, e a camundongos in vivo . PF-4800567 , também desenvolvido pela Pfizer, é um inibidor específico de CK1ε. No entanto, sua capacidade de alongar os ritmos circadianos é mais fraca do que a de PF-670462 em ambos os modelos de fibroblastos de rato in vitro e camundongos in vivo . Os mecanismos de inibição de PF-670462 e PF-4800567 também diferem entre as duas moléculas. PF-670462 mantém CK1ε / δ com o motivo DFG voltado para dentro, enquanto PF-4800567 interage hidrofobicamente com CK1ε / δ para virar o motivo DFG para fora, indicativo de uma quinase do tipo II.
IC261
IC261 é um inibidor que tem como alvo o sítio de ligação de ATP de CK1δ e CK1ε. Da mesma forma, foi demonstrado que prolonga o período circadiano em fibroblastos de rato e tem sido implicado em terapias de tratamento de câncer para câncer pancreático e neuroblastômico.
Outros
Outros inibidores de CK1, como D4476, e análogos de pirazolopiridina , que ambos visam CK1δ, foram caracterizados por terem habilidades terapêuticas, mas seus efeitos benéficos não são bem estudados e podem derivar de outros alvos celulares.