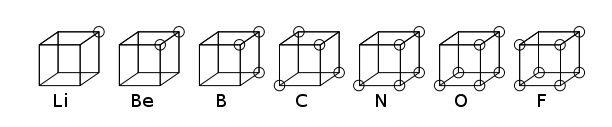
Átomo cúbico - Cubical atom
O átomo cúbico era um dos primeiros modelos atômicos em que os elétrons eram posicionados nos oito cantos de um cubo em um átomo ou molécula não polar. Esta teoria foi desenvolvida em 1902 por Gilbert N. Lewis e publicada em 1916 no artigo "The Atom and the Molecule" e usada para explicar o fenômeno de valência . A teoria de Lewis foi baseada na regra de Abegg . Foi posteriormente desenvolvido em 1919 por Irving Langmuir como o átomo de octeto cúbico . A figura abaixo mostra as representações estruturais dos elementos da segunda linha da tabela periódica .
Embora o modelo cúbico do átomo tenha sido logo abandonado em favor do modelo da mecânica quântica baseado na equação de Schrödinger e, portanto, agora seja principalmente de interesse histórico, ele representou um passo importante para a compreensão da ligação química. O artigo de 1916 de Lewis também introduziu o conceito de par de elétrons na ligação covalente , a regra do octeto e a agora chamada estrutura de Lewis .
Ligação no modelo de átomo cúbico
Ligações covalentes simples são formadas quando dois átomos compartilham uma aresta, como na estrutura C abaixo. Isso resulta no compartilhamento de dois elétrons. As ligações iônicas são formadas pela transferência de um elétron de um cubo para outro sem compartilhar uma aresta (estrutura A ). Um estado intermediário onde apenas um canto é compartilhado (estrutura B ) também foi postulado por Lewis.
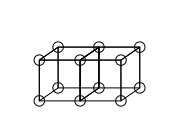
As ligações duplas são formadas pelo compartilhamento de uma face entre dois átomos cúbicos. Isso resulta no compartilhamento de quatro elétrons:
As ligações triplas não poderiam ser explicadas pelo modelo do átomo cúbico, porque não há como ter dois cubos compartilhando três arestas paralelas. Lewis sugeriu que os pares de elétrons nas ligações atômicas têm uma atração especial, que resulta em uma estrutura tetraédrica, como na figura abaixo (a nova localização dos elétrons é representada pelos círculos pontilhados no meio das bordas grossas). Isso permite a formação de uma ligação única compartilhando um canto, uma ligação dupla compartilhando uma borda e uma ligação tripla compartilhando uma face. Também é responsável pela rotação livre em torno de ligações simples e pela geometria tetraédrica do metano.