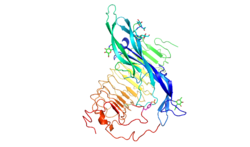
Receptor de hormônio folículo estimulante - Follicle-stimulating hormone receptor
O receptor do hormônio folículo estimulante ou receptor FSH ( FSHR ) é um receptor transmembrana que interage com o hormônio folículo estimulante (FSH) e representa um receptor acoplado à proteína G (GPCR). Sua ativação é necessária para o funcionamento hormonal do FSH. FSHRs são encontrados no ovário , testículos e útero .
Gene FSHR
O gene para o FSHR é encontrado no cromossomo 2 p21 em humanos. A sequência do gene do FSHR consiste em cerca de 2.080 nucleotídeos .
Estrutura do receptor
O FSHR consiste em 695 aminoácidos e tem uma massa molecular de cerca de 76 kDa. Como outros GPCRs, o receptor FSH possui sete domínios que abrangem a membrana ou hélices transmembrana .
- O domínio extracelular do receptor contém 11 repetições ricas em leucina e é glicosilado . Ele tem dois subdomínios, um subdomínio de ligação de hormônio seguido por um subdomínio de especificidade de sinal. O subdomínio de ligação do hormônio é responsável pela ligação do hormônio de alta afinidade, e o subdomínio de especificidade do sinal, contendo uma tirosina sulfatada na posição 335 (sTyr) em uma alça de dobradiça, é necessário para a atividade do hormônio.
- O domínio transmembranar contém dois resíduos de cisteína altamente conservados que constroem ligações dissulfeto para estabilizar a estrutura do receptor. Um motivo tripleto Asp-Arg-Tyr altamente conservado está presente nos membros da família GPCR em geral e pode ser importante para transmitir o sinal. No FSHR e em seus outros membros do receptor do hormônio glicoproteico (LHR e TSHR ), este motivo tripleto conservado é uma variação da sequência Glu-Arg-Trp.
- O domínio C-terminal é intracelular e breve, rico em resíduos de serina e treonina para possível fosforilação .
Ligação de ligante e transdução de sinal
Após a ligação inicial à região LRR de FSHR, FSH remodela sua conformação para formar um novo bolso. FSHR então insere sua sulfotirosina da alça de dobradiça nos bolsos e ativa o domínio transmembranar 7-helicoidal. Este evento leva a uma transdução do sinal que ativa a proteína G que está ligada ao receptor internamente. Com o FSH ligado, o receptor muda a conformação e, assim, ativa mecanicamente a proteína G, que se desprende do receptor e ativa o sistema cAMP .
Acredita-se que uma molécula receptora existe em um equilíbrio conformacional entre os estados ativo e inativo. A ligação do FSH ao receptor altera o equilíbrio entre os receptores ativos e inativos. FSH e agonistas de FSH mudam o equilíbrio em favor de estados ativos; Os antagonistas de FSH mudam o equilíbrio em favor de estados inativos. Para que uma célula responda ao FSH, apenas uma pequena porcentagem (~ 1%) dos locais do receptor precisam ser ativados.
Fosforilação por proteínas quinases dependentes de cAMP
Proteína quinases dependentes de AMP cíclico ( proteína quinase A ) são ativadas pela cadeia de sinal proveniente da proteína G (que foi ativada pelo receptor FSH) via adenilato ciclase e AMP cíclico (cAMP).
Essas proteínas quinases estão presentes como tetrâmeros com duas unidades regulatórias e duas unidades catalíticas. Após a ligação do cAMP às unidades regulatórias, as unidades catalíticas são liberadas e iniciam a fosforilação das proteínas, levando à ação fisiológica. Os dímeros reguladores do AMP cíclico são degradados pela fosfodiesterase e liberam 5'AMP. O DNA no núcleo da célula se liga a proteínas fosforiladas por meio do elemento de resposta do AMP cíclico (CRE), que resulta na ativação de genes .
O sinal é amplificado pelo envolvimento de cAMP e a fosforilação resultante. O processo é modificado pelas prostaglandinas . Outros reguladores celulares participam da concentração intracelular de cálcio modificada pela fosfolipase , ácido nítrico e outros fatores de crescimento.
O receptor FSH também pode ativar as quinases reguladas por sinal extracelular (ERK). Em um mecanismo de feedback , essas quinases ativadas fosforilam o receptor. Quanto mais tempo o receptor permanece ativo, mais quinases são ativadas e mais receptores são fosforilados.
Açao
No ovário, o receptor FSH é necessário para o desenvolvimento folicular e expresso nas células da granulosa .
No homem, o receptor FSH foi identificado nas células de Sertoli que são críticas para a espermatogênese .
O FSHR é expresso durante a fase lútea no endométrio secretor do útero.
O receptor FSH é expresso seletivamente na superfície dos vasos sanguíneos de uma ampla gama de tumores carcinogênicos.
Regulamento do receptor
Regulamentação positiva
A regulação positiva refere-se ao aumento do número de locais de receptor na membrana. O estrogênio regula positivamente os locais do receptor FSH. Por sua vez, o FSH estimula as células da granulosa a produzirem estrogênios . Esta atividade sinérgica de estrogênio e FSH permite o crescimento e desenvolvimento do folículo no ovário.
Dessensibilização
O FSHR torna-se insensível quando exposto ao FSH por algum tempo. Uma reação chave dessa regulação negativa é a fosforilação do domínio do receptor intracelular (ou citoplasmático ) por proteínas quinases . Este processo desacopla a proteína Gs do FSHR. Outra forma de dessensibilizar é desacoplar as unidades reguladoras e catalíticas do sistema cAMP.
Desregulação
A regulação negativa refere-se à diminuição do número de locais do receptor. Isso pode ser realizado através da metabolização dos sítios FSHR ligados. O complexo FSH-receptor ligado é trazido por migração lateral para um "poço revestido", onde tais unidades são concentradas e então estabilizadas por uma estrutura de clatrinas . Um caroço revestido por pinçamento é internalizado e degradado pelos lisossomos . As proteínas podem ser metabolizadas ou o receptor pode ser reciclado. O uso de agonistas de ação prolongada diminuirá a regulação da população de receptores.
Moduladores
Os anticorpos para FSHR podem interferir com a atividade do FSHR.
Anormalidades FSH
Algumas pacientes com síndrome de hiperestimulação ovariana podem apresentar mutações no gene para FSHR, tornando-as mais sensíveis à estimulação com gonadotrofinas.
Mulheres com disgenesia gonadal 46 XX apresentam amenorreia primária com hipogonadismo hipergonadotrópico . Existem formas de disgenesia gonadal 46 xx em que foram relatadas anormalidades no receptor FSH e acredita-se que sejam a causa do hipogonadismo.
O polimorfismo pode afetar as populações de receptores FSH e levar a respostas mais precárias em mulheres inférteis que recebem medicação FSH para fertilização in vitro .
O splicing alternativo do gene FSHR pode estar implicado na subfertilidade em homens
Ligantes
O hormônio folículo-estimulante (FSH) é um agonista do FSHR.
Foram desenvolvidos moduladores alostéricos positivos de pequenas moléculas do FSHR.
História
Alfred G. Gilman e Martin Rodbell receberam o Prêmio Nobel de Medicina e Fisiologia de 1994 pela descoberta do Sistema de Proteína G.
Veja também
Referências
Leitura adicional
- de la Chapelle A (outubro de 1993). "Mapeamento de genes de doenças em populações humanas isoladas: o exemplo da Finlândia" . Journal of Medical Genetics . 30 (10): 857–65. doi : 10.1136 / jmg.30.10.857 . PMC 1016570 . PMID 8230163 .
- Amsterdam A, Hanoch T, Dantes A, Tajima K, Strauss JF, Seger R (fevereiro de 2002). "Mecanismos de dessensibilização de gonadotropina". Endocrinologia Molecular e Celular . 187 (1–2): 69–74. doi : 10.1016 / S0303-7207 (01) 00701-8 . PMID 11988313 . S2CID 23625847 .
- Simoni M, Nieschlag E, Gromoll J (2003). "Isoformas e polimorfismos de nucleotídeo único do gene do receptor FSH: implicações para a reprodução humana" . Atualização da reprodução humana . 8 (5): 413–21. doi : 10.1093 / humupd / 8.5.413 . PMID 12398222 .
- Delbaere A, Smits G, Olatunbosun O, Pierson R, Vassart G, Costagliola S (março de 2004). "Novos insights sobre a fisiopatologia da síndrome de hiperestimulação ovariana. O que faz a diferença entre a síndrome espontânea e iatrogênica?" . Reprodução Humana . 19 (3): 486–9. doi : 10.1093 / humrep / deh124 . PMC 2891954 . PMID 14998941 .
- Bose CK (agosto de 2005). "Papel do fator de crescimento do nervo e receptor FSH no câncer epitelial de ovário" . Biomedicina Reprodutiva Online . 11 (2): 194–7. doi : 10.1016 / S1472-6483 (10) 60958-3 . PMID 16168216 .
- Wunsch A, Sonntag B, Simoni M (junho de 2007). "Polimorfismo do receptor FSH e resposta ovariana ao FSH". Annales d'Endocrinologie . 68 (2–3): 160–6. doi : 10.1016 / j.ando.2007.04.006 . PMID 17544358 .
- Kelton CA, Cheng SV, Nugent NP, Schweickhardt RL, Rosenthal JL, Overton SA, Wands GD, Kuzeja JB, Luchette CA, Chappel SC (novembro de 1992). "A clonagem do receptor do hormônio estimulador do folículo humano e sua expressão em células COS-7, CHO e Y-1". Endocrinologia Molecular e Celular . 89 (1–2): 141–51. doi : 10.1016 / 0303-7207 (92) 90220-Z . PMID 1301382 . S2CID 25403860 .
- Tilly JL, Aihara T, Nishimori K, Jia XC, Billig H, Kowalski KI, Perlas EA, Hsueh AJ (agosto de 1992). "Expressão do receptor do hormônio folículo-estimulante humano recombinante: ligação do ligante específico da espécie, transdução de sinal e identificação de múltiplos transcritos de ácido ribonucleico mensageiro ovariano" . Endocrinology . 131 (2): 799–806. doi : 10.1210 / en.131.2.799 . PMID 1322283 .
- Gromoll J, Gudermann T, Nieschlag E (novembro de 1992). "Clonagem molecular de uma isoforma truncada do receptor do hormônio folículo estimulante humano". Comunicações de pesquisa bioquímica e biofísica . 188 (3): 1077–83. doi : 10.1016 / 0006-291X (92) 91341-M . PMID 1359889 .
- Minegishi T, Nakamura K, Takakura Y, Ibuki Y, Igarashi M, Minegishi T (março de 1991). "Cloning and sequencing of human FSH receiver cDNA". Comunicações de pesquisa bioquímica e biofísica . 175 (3): 1125–30. doi : 10.1016 / 0006-291X (91) 91682-3 . PMID 1709010 .
- Gromoll J, Ried T, Holtgreve-Grez H, Nieschlag E, Gudermann T (junho de 1994). "Localização do receptor FSH humano no cromossomo 2 p21 usando uma sonda genômica compreendendo o exon 10". Journal of Molecular Endocrinology . 12 (3): 265–71. doi : 10.1677 / jme.0.0120265 . PMID 7916967 .
- Gromoll J, Dankbar B, Gudermann T (junho de 1994). "Caracterização da região flanqueadora 5 'do gene receptor do hormônio folículo-estimulante humano". Endocrinologia Molecular e Celular . 102 (1–2): 93–102. doi : 10.1016 / 0303-7207 (94) 90102-3 . PMID 7926278 . S2CID 20112797 .
- Rousseau-Merck MF, Atger M, Loosfelt H, Milgrom E, Berger R (janeiro de 1993). "A localização cromossômica do gene receptor do hormônio folículo estimulante humano (FSHR) em 2p21-p16 é semelhante à do gene do receptor do hormônio luteinizante". Genômica . 15 (1): 222–4. doi : 10.1006 / geno.1993.1041 . PMID 8432542 .
- Jiang X, Dreano M, Buckler DR, Cheng S, Ythier A, Wu H, Hendrickson WA, el Tayar N (dezembro de 1995). "Predições estruturais para a região de ligação do ligante dos receptores de hormônio glicoproteico e a natureza das interações hormônio-receptor" . Estrutura . 3 (12): 1341–53. doi : 10.1016 / S0969-2126 (01) 00272-6 . PMID 8747461 .
- Aittomäki K, Herva R, Stenman UH, Juntunen K, Ylöstalo P, Hovatta O, de la Chapelle A (outubro 1996). "Características clínicas da insuficiência ovariana primária causada por uma mutação pontual no gene do receptor do hormônio estimulador do folículo". The Journal of Clinical Endocrinology and Metabolism . 81 (10): 3722–6. doi : 10.1210 / jc.81.10.3722 . PMID 8855829 .
- Tapanainen JS, Aittomäki K, Min J, Vaskivuo T, Huhtaniemi IT (fevereiro de 1997). "Homens homozigotos para uma mutação inativadora do gene do receptor do hormônio folículo estimulante (FSH) apresentam supressão variável da espermatogênese e da fertilidade". Nature Genetics . 15 (2): 205–6. doi : 10.1038 / ng0297-205 . PMID 9020851 . S2CID 1068731 .
- Kotlar TJ, Young RH, Albanese C, Crowley WF, Scully RE, Jameson JL (abril de 1997). "Uma mutação no receptor do hormônio folículo estimulante ocorre freqüentemente em tumores de cordão sexual de ovário humano". The Journal of Clinical Endocrinology and Metabolism . 82 (4): 1020–6. doi : 10.1210 / jc.82.4.1020 . PMID 9100567 .
links externos
- "Glycoprotein Hormone Receptors: FSH" . Banco de dados de receptores e canais de íons da IUPHAR . União Internacional de Farmacologia Clínica e Básica.
- SSFA-GPHR: Análise de Função de Estrutura de Sequência de Receptores de Hormônio de Glicoproteína
- GRIS: Sistema de Informação do Receptor de Glicoproteína-hormônio