Proteína desempenhando um papel importante na formação de vesículas revestidas
A clatrina é uma proteína que desempenha um papel importante na formação de vesículas revestidas . A clatrina foi isolada e nomeada pela primeira vez por Barbara Pearse em 1976. Ela tem a forma de um triskelion composta por três cadeias pesadas de clatrina e três cadeias leves. Quando os triskelia interagem, eles formam uma rede poliédrica que envolve a vesícula, daí o nome da proteína, que é derivado do latim clathrum que significa rede. Proteínas de revestimento, como a clatrina, são usadas para construir pequenas vesículas a fim de transportar moléculas dentro das células. A endocitose e a exocitose das vesículas permitem que as células se comuniquem, transfiram nutrientes, importem receptores de sinalização, mediem uma resposta imune após a amostragem do mundo extracelular e limpem os restos celulares deixados pela inflamação do tecido. A via endocítica pode ser sequestrada por vírus e outros patógenos para ganhar entrada na célula durante a infecção.
Estrutura
O triskelion de clatrina é composto por três cadeias pesadas de clatrina interagindo em seus terminais C , cada cadeia pesada de ~ 190 kDa tem uma cadeia leve de ~ 25 kDa fortemente ligada a ela. As três cadeias pesadas fornecem a espinha dorsal estrutural da rede de clatrina, e acredita-se que as três cadeias leves regulem a formação e desmontagem de uma rede de clatrina. Existem duas formas de cadeias leves de clatrina, designadas a e b. A principal cadeia pesada da clatrina, localizada no cromossomo 17 em humanos, é encontrada em todas as células. Um segundo gene de cadeia pesada da clatrina, no cromossomo 22 , é expresso no músculo.
A cadeia pesada da clatrina é frequentemente descrita como uma perna, com subdomínios, representando o pé (o domínio N-terminal ), seguido pelo tornozelo, perna distal, joelho, perna proximal e domínios de trimerização. O domínio N-terminal consiste em uma estrutura de hélice β de sete pás. Os outros domínios formam uma super-hélice de hélices alfa curtas. Isso foi originalmente determinado a partir da estrutura do domínio da perna proximal que identificou e é composto por um módulo estrutural menor denominado motivos de repetição de cadeia pesada de clatrina. As cadeias leves ligam-se principalmente à porção da perna proximal da cadeia pesada com alguma interação perto do domínio de trimerização. A hélice β no 'pé' da clatrina contém vários locais de ligação para interação com outras proteínas.
Uma gaiola de clatrina com um único triskelion destacado em azul. O mapa CryoEM EMD_5119 foi renderizado em UCSF Chimera e um triskelion de clatrina foi destacado.
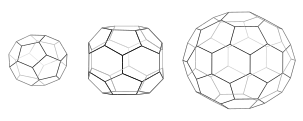
Cada gaiola possui 12 pentágonos. O mini-revestimento (à esquerda) tem 4 hexágonos e simetria tetraédrica como em um tetraedro truncado truncado. Barril hexagonal (meio) tem 8 hexágonos e simetria D6. Bola de futebol (direita) tem 20 hexágonos e simetria icosaédrica como em um icosaedro truncado.
Quando triskelia se reúnem em solução, eles podem interagir com flexibilidade suficiente para formar anéis de 6 lados ( hexágonos ) que produzem uma rede plana, ou anéis de 5 lados ( pentágonos ) que são necessários para a formação de redes curvas. Quando muitos tríscéis se conectam, eles podem formar uma estrutura semelhante a uma cesta. A estrutura apresentada é constituída por 36 triskelia, sendo uma delas a azul. Outra montagem comum é um icosaedro truncado . Para encerrar uma vesícula, exatamente 12 pentágonos devem estar presentes na rede.
Em uma célula, o triskelion de clatrina no citoplasma se liga a uma proteína adaptadora que possui membrana ligada, ligando um de seus três pés à membrana por vez. A clatrina não pode se ligar à membrana ou carga diretamente e, em vez disso, usa proteínas adaptadoras para fazer isso. Este triskelion se ligará a outro triskelia anexado à membrana para formar uma rede arredondada de hexágonos e pentágonos, que lembra os painéis de uma bola de futebol, que puxa a membrana em um botão. Ao construir diferentes combinações de anéis de 5 e 6 lados, vesículas de tamanhos diferentes podem se formar. A menor gaiola de clatrina comumente obtida com a imagem, chamada de mini-casaco, tem 12 pentágonos e apenas dois hexágonos. Mesmo as gaiolas menores com zero hexágonos provavelmente não se formam a partir da proteína nativa, porque os pés da triskelia são muito volumosos.
Função
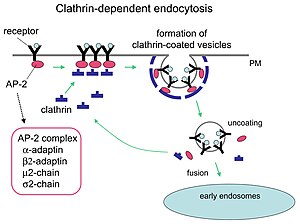
Mecanismo de endocitose mediada por clatrina.
A clatrina desempenha papéis essenciais na formação de vesículas arredondadas no citoplasma para o tráfego intracelular. As vesículas revestidas de clatrina (CCV) classificam seletivamente a carga na membrana celular , na rede trans- Golgi e nos compartimentos endossômicos para várias vias de tráfego da membrana. Depois que uma vesícula brota no citoplasma, o revestimento se desmonta rapidamente, permitindo que a clatrina se recicle enquanto a vesícula é transportada para vários locais.
As moléculas adaptadoras são responsáveis pela automontagem e recrutamento. Dois exemplos de proteínas adaptadoras são AP180 e epsin . AP180 é usado na formação de vesículas sinápticas. Ele recruta clatrina para as membranas e também promove sua polimerização . Epsin também recruta clatrina para membranas e promove sua polimerização, e pode ajudar a deformar a membrana e, assim, vesículas revestidas de clatrina podem brotar. Em uma célula, um tríscele flutuando no citoplasma se liga a uma proteína adaptadora, ligando um de seus pés à membrana por vez. O esqueleto se liga a outros fixados à membrana para formar uma estrutura poliédrica, o esqueleto, que puxa a membrana em um botão. O esqueleto não se liga diretamente à membrana, mas às proteínas adaptadoras que reconhecem as moléculas na superfície da membrana.
A clatrina tem outra função além do revestimento de organelas . Em células que não se dividem, a formação de vesículas revestidas de clatrina ocorre continuamente. A formação de vesículas revestidas de clatrina é interrompida nas células em mitose . Durante a mitose, a clatrina se liga ao aparelho do fuso , em complexo com duas outras proteínas: TACC3 e ch-TOG / CKAP5 . A clatrina auxilia na união dos cromossomos ao estabilizar as fibras cinetocóricas do fuso mitótico . O domínio amino-terminal da cadeia pesada da clatrina e o domínio TACC de TACC3 fazem a superfície de ligação do microtúbulo para que TACC3 / ch-TOG / clatrina se ligue ao fuso mitótico . A estabilização das fibras do cinetóforo requer a estrutura trimérica da clatrina para reticular os microtúbulos.
A endocitose mediada por clatrina (CME) regula muitos processos fisiológicos celulares, como a internalização de fatores e receptores de crescimento, entrada de patógenos e transmissão sináptica. Acredita-se que os invasores celulares usam a via dos nutrientes para obter acesso aos mecanismos de replicação de uma célula. Certas moléculas de sinalização abrem o caminho dos nutrientes. Dois compostos químicos chamados Pitstop 1 e Pitstop 2, inibidores seletivos da clatrina, podem interferir na atividade patogênica e, assim, proteger as células contra a invasão. Estes dois compostos bloqueiam seletivamente a associação do ligante endocítico com o domínio terminal da clatrina in vitro. No entanto, a especificidade desses compostos para bloquear a endocitose mediada por clatrina tem sido questionada.
Veja também
Referências
Leitura adicional
-
Wakeham DE, Chen CY, Greene B, Hwang PK, Brodsky FM (outubro de 2003). "A auto-montagem da clatrina envolve interações fracas coordenadas favoráveis para a regulação celular" . The EMBO Journal . 22 (19): 4980–90. doi : 10.1093 / emboj / cdg511 . PMC 204494 . PMID 14517237 .
-
Ford MG, Mills IG, Peter BJ, Vallis Y, Praefcke GJ, Evans PR, McMahon HT (setembro de 2002). "Curvatura de poços revestidos de clatrina impulsionados por epsin". Nature . 419 (6905): 361–6. Bibcode : 2002Natur.419..361F . doi : 10.1038 / nature01020 . PMID 12353027 . S2CID 4372368 .
-
Fotin A, Cheng Y, Sliz P, Grigorieff N, Harrison SC, Kirchhausen T, Walz T (2004). "Modelo molecular para uma rede de clatrina completa a partir da criomicroscopia eletrônica". Nature . 432 (7017): 573–9. Bibcode : 2004Natur.432..573F . doi : 10.1038 / nature03079 . PMID 15502812 . S2CID 4396282 .
-
Mousavi SA, Malerød L, Berg T, Kjeken R (2004). "Endocitose dependente de clatrina" . Biochemical Journal . 377 (Pt 1): 1-16. doi : 10.1042 / BJ20031000 . PMC 1223844 . PMID 14505490 .
-
Smith CJ, Grigorieff N, Pearse BM (setembro de 1998). "Clathrin reveste com resolução de 21 A: um conjunto celular projetado para reciclar vários receptores de membrana" . The EMBO Journal . 17 (17): 4943–53. doi : 10.1093 / emboj / 17.17.4943 . PMC 1170823 . PMID 9724631 . (Modelo de montagem Clathrin)
-
Pérez-Gómez J, Moore I (março de 2007). "Endocitose de planta: afinal é clatrina" . Biologia atual . 17 (6): R217–9. doi : 10.1016 / j.cub.2007.01.045 . PMID 17371763 . S2CID 17680351 . (Revisão sobre o envolvimento da clatrina na endocitose da planta)
-
Royle SJ, Bright NA, Lagnado L (abril de 2005). “A clatrina é necessária para o funcionamento do fuso mitótico” . Nature . 434 (7037): 1152–7. Bibcode : 2005Natur.434.1152R . doi : 10.1038 / nature03502 . PMC 3492753 . PMID 15858577 .
-
Hood FE, Williams SJ, Burgess SG, Richards MW, Roth D, Straube A, Pfuhl M, Bayliss R, Royle SJ (agosto de 2013). "A coordenação de domínios adjacentes medeia a montagem TACC3-ch-TOG-clatrina e a ligação do fuso mitótico" . J Cell Biol . 202 (3): 463–78. doi : 10.1083 / jcb.201211127 . PMC 3734082 . PMID 23918938 .
-
Knuehl C, Chen CY, Manalo V, Hwang PK, Ota N, Brodsky FM (2006). "Novos locais de ligação na clatrina e adaptadores regulam aspectos distintos da montagem do revestimento" . Traffic . 7 (12): 1688–700. doi : 10.1111 / j.1600-0854.2006.00499.x . PMID 17052248 . S2CID 19087208 .
-
Edeling MA, Smith C, Owen D (2006). "Vida de um revestimento de clatrina: percepções da clatrina e estruturas AP". Nature Reviews Molecular Cell Biology . 7 (1): 32–44. doi : 10.1038 / nrm1786 . PMID 16493411 . S2CID 19393938 .
-
Dutta D, Williamson CD, Cole NB, Donaldson JG (setembro de 2012). "Pitstop 2 é um inibidor potente da endocitose independente da clatrina" . PLOS ONE . 7 (9): e45799. Bibcode : 2012PLoSO ... 745799D . doi : 10.1371 / journal.pone.0045799 . PMC 3448704 . PMID 23029248 .
links externos