Vesícula de gás - Gas vesicle
As vesículas de gás , também conhecidas como vacúolos de gás , são nanocompartimentos em certos organismos procarióticos , que ajudam na flutuabilidade. As vesículas de gás são compostas inteiramente de proteínas ; nenhum lipídio ou carboidrato foi detectado.
Função
As vesículas de gás ocorrem principalmente em organismos aquáticos, pois são usadas para modular a flutuabilidade da célula e modificar a posição da célula na coluna de água para que possa ser localizada de forma ideal para a fotossíntese ou mover-se para locais com mais ou menos oxigênio. Organismos que poderiam flutuar para a interface ar-líquido competem com outros aeróbios que não podem subir em uma coluna de água, por meio do uso de oxigênio na camada superior.
Além disso, as vesículas de gás podem ser usadas para manter a salinidade ideal, posicionando o organismo em locais específicos em um corpo estratificado de água para prevenir o choque osmótico . Altas concentrações de soluto farão com que a água seja retirada da célula por osmose , causando a lise celular. A capacidade de sintetizar vesículas de gás é uma das muitas estratégias que permitem que organismos halofílicos tolerem ambientes com alto teor de sal.
Evolução
As vesículas de gás são provavelmente um dos mecanismos mais antigos de motilidade entre os organismos microscópicos, devido ao fato de ser a forma mais difundida de motilidade conservada no genoma dos procariotos, alguns dos quais evoluíram há cerca de 3 bilhões de anos. Modos de motilidade ativa, como o movimento dos flagelos, requerem um mecanismo que pode converter energia química em energia mecânica e, portanto, é muito mais complexo e teria evoluído mais tarde. As funções das vesículas de gás também são amplamente conservadas entre as espécies, embora o modo de regulação possa ser diferente, sugerindo a importância das vesículas de gás como uma forma de mobilidade. Em certos organismos, como enterobactérias, Serratia sp. A motilidade baseada em flagelos e a produção de vesículas de gás são reguladas de forma oposta por uma única proteína de ligação de RNA, RsmA, sugerindo modos alternativos de adaptação ambiental que teriam se desenvolvido em táxons diferentes através da regulação do desenvolvimento entre a motilidade e a flotação.
Embora haja evidências sugerindo a evolução inicial das vesículas de gás, a transferência de plasmídeo serve como uma explicação alternativa da natureza generalizada e conservada da organela. A clivagem de um plasmídeo em Halobacterium halobium resultou na perda da capacidade de biossintetizar vesículas gasosas, indicando a possibilidade de transferência horizontal de genes , o que poderia resultar na transferência da capacidade de produzir vesículas gasosas entre diferentes cepas de bactérias.
Estrutura

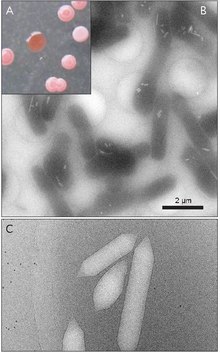
As vesículas de gás são geralmente tubos ocos de proteína em forma de limão ou cilíndricos com tampas cônicas em ambas as extremidades. As vesículas variam mais em seu diâmetro. Vesículas maiores podem reter mais ar e usar menos proteína, tornando-as mais econômicas em termos de uso de recursos, no entanto, quanto maior uma vesícula, mais fraca é estruturalmente sob pressão e menos pressão é necessária antes que a vesícula entre em colapso. Os organismos evoluíram para serem os mais eficientes com o uso de proteínas e usam o maior diâmetro máximo de vesícula que suportará a pressão à qual o organismo pode ser exposto. Para que a seleção natural tenha afetado as vesículas de gás, o diâmetro das vesículas deve ser controlado pela genética. Embora genes que codificam vesículas de gás sejam encontrados em muitas espécies de haloarchaea , apenas algumas espécies os produzem. O primeiro gene da vesícula de gás Haloarchaeal, GvpA , foi clonado de Halobacterium sp. NRC-1. 14 genes estão envolvidos na formação de vesículas de gás em haloarchaea.
O primeiro gene da vesícula de gás, GvpA, foi identificado em Calothrix. Existem pelo menos duas proteínas que compõem a vesícula de gás de uma cianobactéria: GvpA e GvpC. O GvpA forma nervuras e grande parte da massa (até 90%) da estrutura principal. GvpA é fortemente hidrofóbica e pode ser uma das proteínas mais hidrofóbicas conhecidas. O GvpC é hidrofílico e ajuda a estabilizar a estrutura por inclusões periódicas nas costelas GvpA. O GvpC é capaz de ser lavado para fora da vesícula e uma conseqüente diminuição na força da vesícula. A espessura da parede da vesícula pode variar de 1,8 a 2,8 nm. A estrutura estriada da vesícula é evidente nas superfícies interna e externa com um espaçamento de 4-5 nm entre as costelas. As vesículas podem ter 100–1400 nm de comprimento e 45–120 nm de diâmetro.
Dentro de uma espécie, os tamanhos das vesículas de gás são relativamente uniformes, com um desvio padrão de ± 4%.
Crescimento
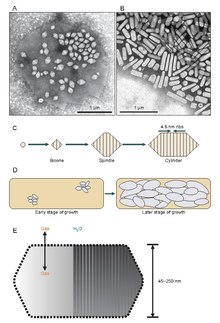
Parece que as vesículas de gás começam sua existência como pequenas estruturas bicônicas (dois cones com as bases planas unidas) que aumentam de tamanho até atingir o diâmetro específico, crescendo e expandindo seu comprimento. Não se sabe exatamente o que controla o diâmetro, mas pode ser uma molécula que interfere com o GvpA ou a forma do GvpA pode mudar.
Regulamento
A formação de vesículas de gás é regulada por duas proteínas Gvp: GvpD, que reprime a expressão das proteínas GvpA e GvpC, e GvpE, que induz a expressão. Fatores ambientais extracelulares também afetam a formação de vesículas, seja por regular a produção da proteína Gvp ou por perturbar diretamente a estrutura da vesícula.
Intensidade da luz
Foi descoberto que a intensidade da luz afeta a produção e manutenção de vesículas de gás de maneira diferente entre as diferentes bactérias e arquéias. Para Anabaena flos-aquae , intensidades de luz mais altas levam ao colapso da vesícula a partir de um aumento na pressão de turgor e maior acúmulo de produtos fotossintéticos. Em cianobactérias, a produção de vesículas diminui em alta intensidade de luz devido à exposição da superfície bacteriana à radiação UV, que pode danificar o genoma bacteriano.
Carboidratos
Verificou- se que o acúmulo de glicose, maltose ou sacarose em Haloferax mediterranei e Haloferax volcanii inibia a expressão de proteínas GvpA e, portanto, diminuía a produção de vesículas de gás. No entanto, isso só ocorreu na fase inicial de crescimento exponencial da célula. A formação de vesículas também pode ser induzida na diminuição das concentrações de glicose extracelular.
Oxigênio
Descobriu-se que a falta de oxigênio afeta negativamente a formação de vesículas de gás em arquéias halofílicas. Halobacterium salinarum produz poucas ou nenhuma vesícula em condições anaeróbias devido à síntese reduzida de transcritos de mRNA que codificam para proteínas Gvp. H. mediterranei e H. volcanii não produzem quaisquer vesículas em condições anóxicas devido a uma diminuição nos transcritos sintetizados que codificam para GvpA e transcritos truncados que expressam GvpD.
pH
Níveis elevados de pH extracelular foram encontrados para aumentar a formação de vesículas em espécies de Microcytis. Sob pH aumentado, os níveis de transcritos de gvpA e gvpC aumentam, permitindo maior exposição aos ribossomos para expressão e levando à regulação positiva das proteínas Gvp. Isso pode ser atribuído à maior transcrição desses genes, diminuição do decaimento dos transcritos sintetizados ou maior estabilidade do mRNA.
Irradiação ultrassônica
A irradiação ultrassônica, em certas frequências, colapsou vesículas de gás na cianobactéria Spirulina platensis , impedindo-as de florescer.
Sensor de quorum
Em enterobacterium; Serratia sp. cepa ATCC39006 , a vesícula de gás é produzida apenas quando há concentração suficiente de uma molécula de sinalização, N-acil homoserina lactona. Nesse caso, a molécula de detecção de quorum , N-acil homoserina lactona, atua como um morfogênio iniciando o desenvolvimento de organela. Isso é vantajoso para o organismo, pois os recursos para a produção de vesículas de gás são utilizados apenas quando há limitação de oxigênio causada pelo aumento da população bacteriana.
Papel no desenvolvimento de vacinas
O gene gvp C da vesícula de gás de Halobacterium sp. é usado como sistema de entrega para estudos de vacinas.
Várias características da proteína codificada pelo gene da vesícula de gás gvp C permitem que ela seja usada como transportadora e adjuvante para antígenos: é estável, resistente à degradação biológica, tolera temperaturas relativamente altas (até 50 ° C) e não patogênica para os humanos. Vários antígenos de vários patógenos humanos foram recombinados no gene gvp C para criar vacinas de subunidade com respostas imunológicas de longa duração.
Diferentes segmentos genômicos que codificam várias proteínas do patógeno Chlamydia trachomatis , incluindo MOMP, OmcB e PompD, são unidos ao gene gvp C de Halobacteria . Avaliações in vitro de células mostram a expressão dos genes de Chlamydia em superfícies celulares por meio de técnicas de imagem e mostram respostas imunológicas características, como atividades de TLRs e produção de citocinas pró-inflamatórias. O gene da vesícula de gás pode ser explorado como um veículo de entrega para gerar uma vacina potencial para Chlamydia. As limitações deste método incluem a necessidade de minimizar o dano da própria proteína GvpC enquanto inclui o máximo do gene alvo da vacina no segmento do gene gvpC .
Um experimento semelhante usa o mesmo gene da vesícula de gás e a proteína efetora de fosfato de inosina secretada do patógeno Salmonella enterica SopB4 e SopB5 para gerar um vetor de vacina potencial. Camundongos imunizados secretam citocinas pró-inflamatórias IFN-γ, IL-2 e IL-9. O anticorpo IgG também é detectado. Após um desafio de infecção, nenhuma ou uma quantidade significativamente menor de bactérias foi encontrada nos órgãos coletados, como o baço e o fígado. Vacinas potenciais usando vesículas de gás como uma exibição de antígeno podem ser administradas por via mucosa como uma via de administração alternativa, aumentando sua acessibilidade a mais pessoas e provocando uma gama mais ampla de respostas imunológicas dentro do corpo.
Papel como agentes de contraste e genes repórter
As vesículas de gás têm várias propriedades físicas que as tornam visíveis em várias modalidades de imagens médicas . A capacidade da vesícula de gás de espalhar luz tem sido usada há décadas para estimar sua concentração e medir sua pressão de colapso. O contraste óptico das vesículas de gás também permite que elas sirvam como agentes de contraste na tomografia de coerência óptica , com aplicações na oftalmologia . A diferença na impedância acústica entre o gás em seus núcleos e o fluido circundante dá às vesículas de gás um contraste acústico robusto . Além disso, a capacidade de algumas conchas das vesículas de gás de se curvarem gera ecos de ultrassom harmônico que melhora o contraste com a proporção do tecido. Finalmente, as vesículas de gás podem ser usadas como agentes de contraste para imagens de ressonância magnética (MRI), contando com a diferença entre a susceptibilidade magnética do ar e da água. A capacidade de colapsar vesículas de gás de forma não invasiva usando ondas de pressão fornece um mecanismo para apagar seu sinal e melhorar seu contraste. Subtrair as imagens antes e depois do colapso acústico pode eliminar os sinais de fundo, aumentando a detecção de vesículas de gás.
A expressão heteróloga de vesículas gasosas em células bacterianas e de mamíferos possibilitou seu uso como a primeira família de genes repórteres acústicos . Embora os genes repórter fluorescentes , como a proteína fluorescente verde (GFP), tenham amplo uso na biologia, suas aplicações in vivo são limitadas pela profundidade de penetração da luz no tecido, normalmente alguns mm. A luminescência pode ser detectada mais profundamente no tecido, mas tem uma resolução espacial baixa. Os genes repórteres acústicos fornecem resolução espacial submilimétrica e uma profundidade de penetração de vários centímetros, permitindo o estudo in vivo de processos biológicos nas profundezas do tecido.

