Intelectina - Intelectin
| Lectina epidérmica embrionária de Xenopus | |||||||
|---|---|---|---|---|---|---|---|
 Estrutura monomérica de XEEL-CRD com D-glicerol 1-fosfato ligado. A proteína é colorida usando um gradiente vermelho-azulado do terminal N ao C. Os íons de cálcio são mostrados como esferas verdes e as moléculas de água coordenadas são mostradas como esferas vermelhas.
| |||||||
| Identificadores | |||||||
| Organismo | |||||||
| Símbolo | itln1 | ||||||
| Entrez | 398574 | ||||||
| HomoloGene | 111044 | ||||||
| PDB | 4WN0 | ||||||
| RefSeq (mRNA) | NM_001089101.1 | ||||||
| RefSeq (Prot) | NP_001082570.1 | ||||||
| UniProt | Q800K0 | ||||||
| |||||||
| Intelectina-1 humana | |||||||
|---|---|---|---|---|---|---|---|
 Estrutura monomérica da intelectina humana com alil-beta-D-galactofuranose ligada. A proteína é colorida usando um gradiente vermelho-azulado do terminal N ao C. Os íons de cálcio são mostrados como esferas verdes e as moléculas de água coordenadas são mostradas como esferas vermelhas.
| |||||||
| Identificadores | |||||||
| Símbolo | ITLN1 | ||||||
| Alt. símbolos | hIntL-1 | ||||||
| Gene NCBI | 55600 | ||||||
| HGNC | 18259 | ||||||
| OMIM | 609873 | ||||||
| PDB | 4WMY | ||||||
| RefSeq | NP_060095 | ||||||
| UniProt | Q8WWA0 | ||||||
| Outros dados | |||||||
| Locus | Chr. 1 q21.3 | ||||||
| |||||||
Intelectinas são lectinas (proteínas de ligação a carboidratos) expressas em humanos e outros cordados . Os seres humanos expressam dois tipos de intelectins codificados por ITLN1 e ITLN2 genes , respectivamente. Várias intelectinas se ligam a resíduos de carboidratos específicos de micróbios. Portanto, as intelectinas têm sido propostas para funcionar como lectinas imunes. Embora as intelectinas contenham um domínio semelhante ao fibrinogênio encontrado na família das lectinas imunes das ficolinas , há uma divergência estrutural significativa. Assim, as intelectinas podem não funcionar através da mesma via do complemento da lectina. A maioria das intelectinas ainda é mal caracterizada e podem ter diversos papéis biológicos. A intelectina-1 humana (hIntL-1) também demonstrou se ligar à lactoferrina , mas a consequência funcional ainda não foi elucidada. Além disso, o hIntL-1 é o principal componente do muco asmático e também pode estar envolvido na fisiologia da insulina.
Diversidade
A primeira intelectina foi descoberta no oócito de Xenopus laevis e é chamada de XL35 ou XCGL-1. O oócito X. laevis também contém um XCGL-2 intimamente relacionado. Além disso, os embriões de X. laevis secretam lectina epidérmica embrionária de Xenopus na água ambiental, presumivelmente para ligar micróbios. XSL-1 e XSL-2 também são expressos em soro X. laevis quando estimulados com lipopolissacarídeo. Duas intelectinas intestinais adicionais são descobertas em X. laevis
Humano tem duas intelectinas: hIntL-1 (omentin) e hIntL-2. O mouse também possui duas intelectinas: mIntL-1 e mIntL-2.
Sistema imunológico
Várias linhas de evidência sugerem que as intelectinas reconhecem micróbios e podem funcionar como uma proteína de defesa imunológica inata. O tunicado intelectina é uma opsonina para fagocitose pelo hemócito. Demonstrou-se que a intelectina anfioxus aglutina bactérias. No peixe-zebra e na truta arco-íris, a expressão da intelectina é estimulada após a exposição microbiana. Mamíferos como ovelhas e camundongos também regulam positivamente a expressão de intelectina após a infecção parasitária. O aumento na expressão da intelectina após a exposição microbiana apóia a hipótese de que as intelectinas desempenham um papel no sistema imunológico.
Estrutura
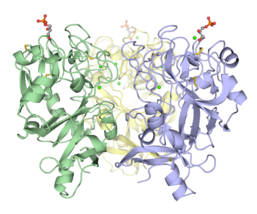
Embora intelectins requerem iões de cálcio para a função, as sequências não têm qualquer semelhança com as lectinas do tipo C . Além disso, apenas cerca de 50 aminoácidos (o domínio semelhante ao fibronogênio) se alinham com qualquer proteína conhecida, especificamente a família ficolina . Os primeiros detalhes estruturais de uma intelectina vêm da estrutura cristalina do domínio de reconhecimento de carboidratos XEEL marcado com selenometionina (Se-Met XEEL-CRD) resolvido por Se- SAD . O XEEL-CRD foi expresso e marcado com Se-Met em células de inseto High Five usando um baculovírus recombinante . A dobra semelhante ao fibrinogênio é conservada apesar da divergência da sequência de aminoácidos. No entanto, extensas inserções estão presentes na intelectina em comparação com as ficolinas, tornando a intelectina uma classe estrutural distinta da lectina. A estrutura Se-Met XEEL-CRD permite a solução da estrutura por substituição molecular de XEEL-CRD ligado a D-glicerol 1 (GroP), intelectina-1 apo-humana (hIntL-1) e hIntL- ligado à galactofuranose 1
Cada cadeia polipeptídica de XEEL e hIntL-1 contém três íons de cálcio ligados: dois no sítio de cálcio estrutural e um no sítio de ligação do ligante. Os resíduos de aminoácidos no sítio de cálcio estrutural são conservados entre as intelectinas, portanto, é provável que a maioria, senão todas, as intelectinas tenham dois íons de cálcio estruturais.
No sítio de ligação do ligante de XEEL e hIntL-1, o diol exocíclico vicinal do ligante de carboidrato se coordena diretamente com o íon cálcio. Existem grandes variações nos resíduos do local de ligação do ligante entre os homólogos da intelectina, sugerindo que a família da intelectina pode ter amplas especificidades do ligante e funções biológicas. Como não há convenções de numeração de intelectina em organismos diferentes, não se deve presumir homologia funcional com base no número de intelectina. Por exemplo, o hIntL-1 possui resíduos de ácido glutâmico no local de ligação do ligante para coordenar um íon de cálcio, enquanto a intelectina-1 do peixe-zebra é desprovida desses resíduos ácidos. Os resíduos do sítio de ligação do ligante da intelectina-2 do peixe-zebra são semelhantes aos presentes no hIntL-1.
Estado oligomérico
hIntL-1 é um trímero ligado por dissulfeto, conforme mostrado por SDS-PAGE não redutor e cristalografia de raios-X. Apesar de não ter ligações dissulfeto intermoleculares, o XEEL-CRD é trimérico em solução. O peptídeo N-terminal do XEEL de comprimento total é responsável por dimerizar o XEEL-CRD trimérico em um XEEL de comprimento total hexamérico ligado por dissulfeto. Portanto, os terminais N das intelectinas são frequentemente responsáveis pela formação de oligômeros ligados por dissulfeto. Em homólogos de intelectina onde as cisteínas N-terminais estão ausentes, o próprio CRD pode ainda ser capaz de formar um oligômero não covalente em solução.
Referências
Leitura adicional
- Wesener DA, Wangkanont K, McBride R, Song X, Kraft MB, Hodges HL, Zarling LC, Splain RA, Smith DF, Cummings RD, Paulson JC, Forest KT, Kiessling LL (agosto de 2015). "Reconhecimento de glicanos microbianos pela intelectina-1 humana" . Nature Structural & Molecular Biology . 22 (8): 603–10. doi : 10.1038 / nsmb.3053 . PMC 4526365 . PMID 26148048 .para análise exaustiva de ligação de ligante de intelectina-1 humana (hIntL-1). O artigo também revela como o hIntL-1 pode discriminar entre células microbianas e de mamíferos.
- Wangkanont K, Wesener DA, Vidani JA, Kiessling LL, Forest KT (janeiro de 2016). "As estruturas da lectina epidérmica embrionária de Xenopus revelam um mecanismo conservado de reconhecimento de glicano microbiano" . The Journal of Biological Chemistry . 291 (11): 5596–610. doi : 10.1074 / jbc.M115.709212 . PMC 4786701 . PMID 26755729 .para discussão sobre como a primeira estrutura da intelectina (XEEL-CRD) foi resolvida. Análises biofísicas e evolutivas aprofundadas da família da intelectina à luz das estruturas 3D disponíveis também fornecem percepções significativas sobre esta família de proteínas não apreciadas anteriormente. O artigo serve como a revisão mais atualizada sobre a bioquímica da família da intelectina.
- Yan J, Xu L, Zhang Y, Zhang C, Zhang C, Zhao F, Feng L (outubro de 2013). "Análises comparativas genômicas e filogenéticas da família de genes da intelectina: implicações para sua origem e evolução". Imunologia de desenvolvimento e comparativa . 41 (2): 189–99. doi : 10.1016 / j.dci.2013.04.016 . PMID 23643964 . para análise genômica abrangente de intelectinas de vários organismos.