Reação de Schmidt - Schmidt reaction
A reação de Schmidt é uma reação orgânica na qual uma azida reage com um derivado de carbonila , geralmente um aldeído, cetona ou ácido carboxílico, sob condições ácidas para dar uma amina ou amida , com expulsão de nitrogênio. Recebeu o nome de Karl Friedrich Schmidt (1887–1971), que o relatou pela primeira vez em 1924 ao converter com sucesso a benzofenona e o ácido hidrazóico em benzanilida . Surpreendentemente, a reação intramolecular não foi relatada até 1991, mas tornou-se importante na síntese de produtos naturais.
| Reação de Schmidt | |
|---|---|
| Nomeado após | Karl Friedrich Schmidt |
| Tipo de reação | Reação de rearranjo |
| Identificadores | |
| Portal de Química Orgânica | reação de schmidt |
| ID de ontologia RSC | RXNO: 0000170 |
A reação é eficaz com ácidos carboxílicos para dar aminas (acima) e com cetonas para dar amidas (abaixo).
Mecanismo de reação
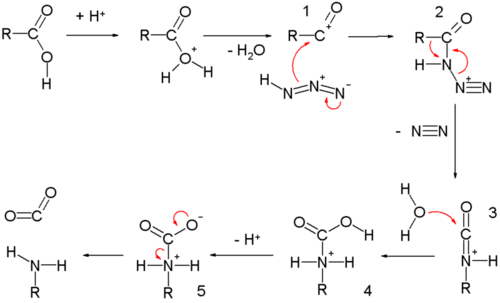
A reação está intimamente relacionada ao rearranjo de Curtius, exceto que nesta reação a acil azida é produzida pela reação do ácido carboxílico com o ácido hidrazóico através do ácido carboxílico protonado, em um processo semelhante à esterificação de Fischer . Uma alternativa, envolvendo a formação de um íon acílio, torna-se mais importante quando a reação ocorre em ácido concentrado (> 90% de ácido sulfúrico). (No rearranjo de Curtius, a azida de sódio e um cloreto de acila são combinados para gerar quantitativamente o intermediário de acil azida e o resto da reação ocorre em condições neutras.)
A reação de Schmidt com ácido carboxílico começa com o íon acílio 1 obtido por protonação e perda de água. A reação com o ácido hidrazóico forma a azido cetona protonada 2 , que passa por uma reação de rearranjo com o grupo alquil R, migrando sobre a ligação CN com expulsão do nitrogênio. O isocianato protonado é atacado pela água formando o carbamato 4 , que após a desprotonação perde dióxido de carbono para a amina .
No mecanismo de reação para a reação de Schmidt das cetonas , o grupo carbonil é ativado por protonação para adição nucleofílica pela azida, formando a azidoidrina 3 , que perde água em uma reação de eliminação ao diazoimínio 5. Um dos grupos alquil ou aril migra do carbono ao nitrogênio com perda de nitrogênio para dar um nitrílio intermediário 6 , como no rearranjo de Beckmann . Ataque por convertidos de água 6 para o ácido imídico protonado 7 , o qual é submetido a perda de protão para chegar ao ácido imídico tautómero do último amida . Em um mecanismo alternativo, a migração ocorre em 9 , diretamente após a protonação do intermediário 3 , de maneira semelhante à reação de Baeyer-Villiger para dar a amida protonada 10 . A perda de um próton novamente fornece a amida. Foi proposto que a desidratação para 3 para dar 5 (e, portanto, a via de Beckmann) é favorecida por ácidos não aquosos como conc. H 2 SO 4 , enquanto os ácidos aquosos como HCl conc. HCl favorece a migração de 9 (a via Baeyer-Villiger). Essas possibilidades foram usadas para explicar o fato de que, para certos substratos como α-tetralona , o grupo que migra pode às vezes mudar, dependendo das condições usadas, para entregar qualquer uma das duas amidas possíveis.
Reações envolvendo alquil azidas
O escopo desta reação foi estendido para reações de carbonilas com alquil azidas RN 3 . Esta extensão foi relatada pela primeira vez por JH Boyer em 1955 (daí o nome de reação de Boyer ), por exemplo, a reação de m-nitrobenzaldeído com β-azido-etanol :
Variações envolvendo reações de Schmidt intramoleculares são conhecidas desde 1991. Essas são reações de anulação e têm alguma utilidade na síntese de produtos naturais; como lactamas e alcalóides .