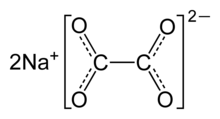
Oxalato de sódio - Sodium oxalate
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
Oxalato dissódico |
|
| Outros nomes
Ácido oxálico, sal dissódico
etanodioato de sódio |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100.000.501 |
| Número EC | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Na 2 C 2 O 4 | |
| Massa molar | 133,999 g mol −1 |
| Densidade | 2,34 g cm −3 |
| Ponto de fusão | 260 ° C (500 ° F; 533 K) se decompõe acima de 290 ° C |
| 2,69 g / 100 mL (0 ° C) 3,7 g / 100 mL (20 ° C) 6,25 g / 100 mL (100 ° C) |
|
| Solubilidade | solúvel em ácido fórmico insolúvel em álcool , éter |
| Estrutura | |
| monoclínico | |
| Termoquímica | |
| -1318 kJ / mol | |
| Perigos | |
| Ficha de dados de segurança | Oxford MSDS |
|
|
|
| NFPA 704 (diamante de fogo) | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
11160 mg / kg (oral, rato) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Oxalato de sódio , ou oxalato dissódico , é o sal de sódio do ácido oxálico com a fórmula Na 2 C 2 O 4 . É um branco, cristalino, inodora sólido, que se decompõe acima de 290 ° C .
O oxalato dissódico pode atuar como um agente redutor e pode ser usado como um padrão primário para padronizar soluções de permanganato de potássio (KMnO 4 ).
A forma mineral do oxalato de sódio é o natroxalato . É muito raramente encontrado e restrito a condições extremamente sódicas de pegmatitos ultra-alcalinos .
Preparação
O oxalato de sódio pode ser preparado através da neutralização do ácido oxálico com hidróxido de sódio (NaOH) em uma razão molar ácido-base de 1: 2. A evaporação produz o oxalato anidro que pode ser completamente seco por aquecimento entre 200 e 250 ° C.
A meia neutralização pode ser realizada com NaOH em uma proporção de 1: 1 que produz NaHC 2 O 4 , oxalato de sódio monobásico ou hidrogenoxalato de sódio .
Em alternativa, pode ser produzido decompondo o formato de sódio por aquecimento a uma temperatura superior a 360 ° C.
Reações
O oxalato de sódio começa a se decompor acima de 290 ° C em carbonato de sódio e monóxido de carbono :
-
N / D
2C
2O
4→ Na
2CO
3+ CO
Quando aquecido entre 200 e 525 ° C com pentóxido de vanádio em uma razão molar de 1: 2, a reação acima é suprimida, rendendo, em vez disso, um oxibronze de sódio vanádio com liberação de dióxido de carbono
-
x Na
2C
2O
4+ 2 V
2O
5→ 2 Na
xV
2O
5+ 2 x CO
2
com x aumentando até 1 conforme a temperatura aumenta.
Oxalato de sódio é usado para padronizar soluções de permanganato de potássio . É desejável que a temperatura da mistura de titulação seja superior a 60 ° C para garantir que todo o permanganato adicionado reaja rapidamente. A cinética da reação é complexa e os íons manganês (II) formados catalisam a reação posterior entre o permanganato e o ácido oxálico (formado in situ pela adição de ácido sulfúrico em excesso). A equação final é a seguinte:
- 5 Na 2 C 2 O 4 + 2 KMnO 4 + 8 H 2 SO 4 → K 2 SO 4 + 5 Na 2 SO 4 + 2 MnSO 4 + 10 CO 2 + 8 H 2 O
Atividade biológica
Como vários outros oxalatos , o oxalato de sódio é tóxico para os humanos. Pode causar dor em queimação na boca, garganta e estômago, vômito com sangue, dor de cabeça, cãibras musculares, cãibras e convulsões, queda da pressão arterial, insuficiência cardíaca, choque, coma e possível morte. A dose letal média por ingestão de oxalatos é de 10-15 gramas / quilograma de peso corporal (por MSDS ).
O oxalato de sódio, como os citratos , também pode ser usado para remover os íons de cálcio (Ca 2+ ) do plasma sanguíneo. Também evita a coagulação do sangue. Observe que, ao remover os íons de cálcio do sangue, o oxalato de sódio pode prejudicar a função cerebral e depositar oxalato de cálcio nos rins.

