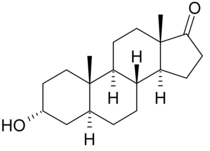
Androsterone - Androsterone
 | |
 | |
| Dados clínicos | |
|---|---|
| Outros nomes | 3α-hidroxi-5α-androstan-17-ona, 5α-androstan-3α-ol-17-ona |
| Código ATC | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.000.159 |
| Dados químicos e físicos | |
| Fórmula | C 19 H 30 O 2 |
| Massa molar | 290,447 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| (verificar) | |
A androsterona , ou 3α-hidroxi-5α-androstan-17-ona , é um hormônio esteróide endógeno , neuroesteróide e feromônio putativo . É um andrógeno fraco com potência de aproximadamente 1/7 da testosterona . A androsterona é um metabólito da testosterona e da diidrotestosterona (DHT). Além disso, pode ser convertido de volta em DHT via 3α-hidroxiesteróide desidrogenase e 17β-hidroxiesteróide desidrogenase , ignorando intermediários convencionais como androstanediona e testosterona e, como tal, pode ser considerado um intermediário metabólico por si só.
A androsterona também é conhecida por ser um neuroesteróide androstano inibitório , atuando como um modulador alostérico positivo do receptor GABA A e possui efeitos anticonvulsivantes . O enantiômero não natural da androsterona é mais potente como modulador alostérico positivo dos receptores GABA A e como anticonvulsivante do que a forma natural. O isômero 3β da androsterona é a epiandrosterona , e seu epímero 5β é a etiocolanolona . O isômero 3β, 5β é epietiocolanolona .
Função biológica
A androsterona geralmente é considerada um metabólito inativo da testosterona, que quando conjugada por glucuronidação e sulfatação permite que a testosterona seja removida do corpo, mas é um neuroesteróide fraco que pode atravessar para o cérebro e ter efeitos na função cerebral.
A visão da androsterona como sendo geralmente de baixa significância, entretanto, parece precisar de revisão à luz da pesquisa do século 21, que sugere que a androsterona afeta significativamente a masculinização em fetos mamíferos. A masculinização da genitália externa em humanos está sujeita à diidrotestosterona (DHT) derivada da via androgênica reconhecida e também por uma via dos fundos . Portanto, o androstanodiol pode ser usado como um marcador da via dos fundos da síntese de DHT. Estudos espectrométricos identificam a androsterona como o principal andrógeno backdoor no feto humano masculino. Os níveis circulantes dependem do sexo, sendo DHT essencialmente ausente nas mulheres, nas quais os títulos de intermediários backdoor também são muito baixos.
Nos homens, os intermediários backdoor ocorrem principalmente no fígado e adrenal do feto, e na placenta - quase nenhum no testículo. Em vez disso, a progesterona na placenta é o principal substrato da porta dos fundos para a síntese de andrógenos. Isso também é consistente com a observação de que a insuficiência placentária tem sido associada a distúrbios do desenvolvimento da genitália fetal.
Feromônio
A androsterona é encontrada na axila e na pele humanas , bem como na urina . Também pode ser secretado pelas glândulas sebáceas humanas . É descrito como tendo um odor almiscarado semelhante ao do androstenol . Foi descoberto que a androsterona afeta o comportamento humano quando cheirada.
Bioquímica
Biossíntese
A androsterona e seu isômero 5β , a etiocolanolona , são produzidos no corpo como metabólitos da testosterona . A testosterona é convertida em 5α-dihidrotestosterona e 5β-dihidrotestosterona pela 5α-redutase e 5β-redutase , respectivamente. A enzima 3α-hidroxiesteróide desidrogenase converte as formas reduzidas em 3α-androstanodiol e 3β-androstanodiol , que são subsequentemente convertidos pela 17β-hidroxiesteróide desidrogenase em androsterona e etiocolanolona, respectivamente. A androsterona e a etiocolanolona também podem ser formadas a partir da androstenediona através da ação da 5α-redutase e 5β-redutase formando 5α-androstanediona e 5β-androstanediona que são então convertidas em androsterona e etiocolanolona pela 3α-hidroxiesteróide desidrogenase e 3β-hidroxisteróide desidrogenase , respectivamente.
Metabolismo
A androsterona é sulfatada em sulfato de androsterona e glucuronidada em glucuronídeo de androsterona e esses conjugados são excretados na urina .
Química
Fontes
Foi demonstrado que a androsterona ocorre naturalmente no pólen de pinheiro e é bem conhecida em muitas espécies animais .
História
A androsterona foi isolada pela primeira vez em 1931, por Adolf Friedrich Johann Butenandt e Kurt Tscherning . Eles destilaram mais de 17.000 litros (3.700 imp gal; 4.500 US gal) de urina masculina, dos quais obtiveram 50 miligramas (0,77 gr) de androsterona cristalina, o que foi suficiente para descobrir que a fórmula química era muito semelhante à estrona .
Veja também
- Caminho da porta dos fundos do andrógeno
- Lista de andrógenos / esteróides anabolizantes
- Lista de neuroesteróides § Androstanos
- Lista de neuroesteroides § Feromônios e ferinas
