Síntese de carboidratos - Carbohydrate synthesis
A síntese de carboidratos é um subcampo da química orgânica preocupado especificamente com a geração de estruturas de carboidratos naturais e não naturais . Isso pode incluir a síntese de resíduos de monossacarídeos ou estruturas contendo mais de um monossacarídeo, conhecidos como oligossacarídeos .
Fundo
De um modo geral, os carboidratos podem ser classificados em dois grupos, açúcares simples e carboidratos complexos. Açúcares simples, também chamados de monossacarídeos, são carboidratos que não podem ser convertidos em açúcares menores por hidrólise . Quando duas ou mais unidades de monossacarídeo são conectadas por meio de uma ligação de glicosídeo , carboidratos complexos são formados. Os carboidratos complexos, de acordo com o número diferente de unidades monossacarídicas, podem ser classificados em três grupos: dissacarídeos , oligossacarídeos e polissacarídeos . Um dissacarídeo é formado a partir de dois monossacarídeos. Os oligossacarídeos podem ser formados por um pequeno número de monossacarídeos ligados entre si. Os oligossacarídeos superiores são chamados de polissacarídeos. Agora é bem conhecido que os glicoconjugados desempenham um papel indispensável em muitos processos biológicos. Esses processos biológicos nos quais os carboidratos estão envolvidos estão tipicamente associados não aos monossacarídeos, mas às estruturas de oligossacarídeos dos glicoconjugados. Portanto, a síntese de oligossacarídeos torna-se cada vez mais importante no estudo das atividades biológicas.
Síntese de oligossacarídeos
Os oligossacarídeos têm estruturas diversas. O número de monossacarídeos, tamanho do anel, a estereoquímica anomérica diferente e a existência de açúcares de cadeia ramificada contribuem para a incrível complexidade das estruturas de oligossacarídeos. A essência da síntese de oligossacarídeos redutores é conectar a hidroxila anomérica dos doadores de glicosila aos grupos hidroxila alcoólica dos aceitadores de glicosila . A proteção dos grupos hidroxila do aceitador com o grupo hidroxila alcoólico alvo desprotegido pode assegurar o controle regioquímico. Além disso, fatores como os diferentes grupos de proteção, o solvente e os métodos de glicosilação podem influenciar as configurações anoméricas. Este conceito é ilustrado por uma síntese de oligossacarídeos no Esquema 1. A síntese de oligossacarídeos normalmente consiste em quatro partes: preparação dos doadores de glicosila, preparação dos aceitadores de glicosila com um único grupo hidroxila desprotegido, o acoplamento deles e o processo de desproteção .
Blocos de construção
Os doadores comuns na síntese de oligossacarídeos são haletos de glicosil , glicosil acetatos, tioglicosídeos , tricloroacetimidatos, pentenil glicosídeos e glicais . De todos esses doadores, os halogenetos de glicosila são doadores clássicos, que desempenharam um papel histórico no desenvolvimento de reações de glicosilação. Doadores de tioglicosídeo e tricloroacetimidato são usados mais do que outros nos métodos de glicosilação contemporâneos. Quando se trata do método do tricloroacetimidato, uma das vantagens é que não há necessidade de introdução de reagentes de metais pesados no processo de ativação. Além disso, o uso de diferentes bases pode levar seletivamente a diferentes configurações anoméricas. (Esquema 2) Quanto aos tioglicosídeos, o maior ponto forte é que eles podem oferecer proteção temporária ao centro anomérico, pois podem sobreviver após a maioria dos processos de ativação. Além disso, uma variedade de métodos de ativação podem ser empregados, tais como NIS / AgOTf, NIS / TfOH, IDCP ( Iodo Dicolidina Perclorato ), iodo e Ph 2 SO / Tf 2 O. Além disso, na preparação de 1, 2-trans a ligação glicosídica, utilizando tioglicosídeos e imidatos, pode promover o rearranjo dos subprodutos do ortoéster, uma vez que as misturas de reação são suficientemente ácidas.
Estereosseletividade
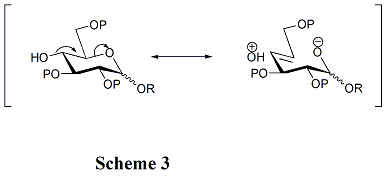
As estruturas de aceitadores desempenham um papel crítico na taxa e estereosseletividade das glicosilações. Geralmente, os grupos hidroxila desprotegidos são menos reativos quando estão entre grupos protetores volumosos. Essa é a razão pela qual o grupo hidroxila em OH-4 em piranósidos não é reativo. A hiperconjugação está envolvida quando OH-4 é anti-periplanar ao oxigênio do anel, o que também pode reduzir sua reatividade. (Esquema 3) Além disso, grupos de proteção de acila podem reduzir a reatividade dos aceitadores em comparação com grupos de proteção de alquila por causa de sua capacidade de retirar elétrons. O grupo hidroxila em OH-4 de derivados de N-acetilglucosamina é particularmente não reativo.
A ligação glicosídica é formada a partir de um doador de glicosil e um aceitador de glicosil. Existem quatro tipos de ligações glicosídicas: ligações 1, 2-trans-α, 1, 2-trans-beta, 1, 2-cis-α e 1, 2-cis-beta. As ligações glicosídicas 1, 2-trans podem ser facilmente alcançadas usando doadores de glicosil 2-O-acilados (participação do grupo vizinho). Para evitar o acúmulo de intermediários ortoéster , a condição de glicosilação deve ser ligeiramente ácida.
Ligações difíceis
É um pouco mais difícil preparar ligações 1, 2-cis-β-glicosídicas estereosseletivamente. Normalmente, quando grupos não participantes na posição O-2, a ligação 1, 2-cis-β pode ser alcançada usando os métodos de íon haleto historicamente importantes ou usando doadores de glicosil 2-O-alquilados, comumente tioglicosídeos ou tricloroacetimidatos , em solventes não polares.
No início dos anos 1990, ainda era o caso de que a ligação do manosídeo beta era muito desafiadora para ser tentada por amadores. No entanto, o método introduzido por Crich (Esquema 4), com proteção de 4,6-benzilideno um pré-requisito e alfa triflato anomérico um intermediário chave deixa este problema essencialmente resolvido. A abordagem de entrega de aglicona intramolecular (IAD) desenvolvida concomitantemente, mas um tanto mais prolongada , é uma alternativa pouco usada, mas estereoespecífica.
Veja também
Referências
links externos
-
 Mídia relacionada à síntese de carboidratos no Wikimedia Commons
Mídia relacionada à síntese de carboidratos no Wikimedia Commons