Hiperconjugação - Hyperconjugation
Em química orgânica , a hiperconjugação (ou conjugação σ ) refere-se à deslocalização de elétrons com a participação de ligações de caráter principalmente σ. Normalmente, hiperconjugação envolve a interacção dos electrões em um sigma (σ) orbital (por exemplo, C-H ou C-C) com um adjacente despovoado não-ligação p ou antibonding σ * ou p * orbitais para dar um par de estendidos orbitais moleculares . No entanto, às vezes, orbitais σ * anti-colantes baixos também podem interagir com orbitais preenchidos de caráter de par solitário (n) no que é denominado 'hiperconjugação negativa'. O aumento da deslocalização de elétrons associada à hiperconjugação aumenta a estabilidade do sistema. Em particular, o novo orbital com caráter de ligação é estabilizado, resultando em uma estabilização geral da molécula. Apenas elétrons em ligações que estão na posição β podem ter esse tipo de efeito estabilizador direto - doando de uma ligação sigma em um átomo para um orbital em outro átomo diretamente ligado a ele. No entanto, versões estendidas de hiperconjugação (como hiperconjugação dupla) também podem ser importantes. O efeito Baker-Nathan , às vezes usado como sinônimo de hiperconjugação, é uma aplicação específica dele a certas reações químicas ou tipos de estruturas.
Formulários
A hiperconjugação pode ser usada para racionalizar uma variedade de fenômenos químicos, incluindo o efeito anomérico , o efeito gauche , a barreira rotacional do etano , o efeito beta-silício , a frequência vibracional de grupos carbonil exocíclicos e a estabilidade relativa de carbocações substituídas e substituídas radicais centrados no carbono e a regra termodinâmica de Zaitsev para a estabilidade do alceno. Mais controversamente, a hiperconjugação é proposta pela modelagem da mecânica quântica como uma explicação melhor para a preferência da conformação escalonada em vez da velha noção de obstáculo estérico .
Efeito nas propriedades químicas
A hiperconjugação afeta várias propriedades.
- Comprimento da ligação : A hiperconjugação é sugerida como um fator chave no encurtamento das ligações sigma (ligações σ). Por exemplo, as ligações C – C simples em 1,3-butadieno e Propino têm aproximadamente 1,46 angstrom de comprimento, muito menos do que o valor de cerca de 1,54 Å encontrado em hidrocarbonetos saturados . Para o butadieno, isso pode ser explicado como a conjugação normal das duas partes alquenil. Mas para Propino, hiperconjugação entre as partes alquil e alquinil.
- Momentos dipolares: O grande aumento no momento dipolar do 1,1,1-tricloroetano em comparação com o clorofórmio pode ser atribuído a estruturas hiperconjugadas.
- O calor de formação das moléculas com hiperconjugação é maior que a soma de suas energias de ligação e os calores de hidrogenação por dupla ligação são menores que o calor de hidrogenação do etileno .
- Estabilidade de carbocations :
- (CH 3 ) 3 C + > (CH 3 ) 2 CH + > (CH 3 ) CH 2 + > CH 3 +
- As três ligações C – H σ do (s) grupo (s) metil (is) ligado (s) ao carbocátion podem sofrer a interação de estabilização, mas apenas uma delas pode ser alinhada perfeitamente com o orbital p vazio, dependendo da conformação da ligação carbono-carbono. A doação de dois títulos C – H desalinhados é mais fraca. Quanto mais grupos metil adjacentes houver, maior será a estabilização da hiperconjugação devido ao aumento do número de ligações C – H adjacentes.
Hiperconjugação em compostos insaturados
A hiperconjugação foi sugerida como a razão para o aumento da estabilidade das ligações duplas carbono-carbono à medida que o grau de substituição aumenta. Os primeiros estudos em hiperconjugação foram realizados pelo grupo de pesquisa de George Kistiakowsky . Seu trabalho, publicado pela primeira vez em 1937, pretendia ser um relatório de progresso preliminar de estudos termoquímicos de mudanças de energia durante reações de adição de vários compostos insaturados e cíclicos. A importância da hiperconjugação na contabilização desse efeito recebeu suporte de cálculos de química quântica. Acredita-se que a interação chave seja a doação da densidade de elétrons da ligação σ C – H vizinha para o orbital anticolante π * do alceno (σ C – H → π *). O efeito é quase uma ordem de magnitude mais fraco do que no caso de substituição de alquil em carbocations (σ C – H → p C ), uma vez que um orbital p não preenchido é mais baixo em energia e, portanto, melhor combinado energeticamente com uma ligação σ. Quando esse efeito se manifesta na formação do produto mais substituído em reações E1 termodinamicamente controladas, é conhecido como regra de Zaitsev , embora em muitos casos o produto cinético também siga essa regra. ( Consulte a regra de Hofmann para os casos em que o produto cinético é o menos substituído. )
Um conjunto de experimentos de Kistiakowsky envolveu dados coletados de dados de hidrogenação durante reações em fase gasosa de uma série de compostos que continham uma unidade de alceno . Quando se comparam uma gama de mono alquilo substituído com alcenos, eles encontraram qualquer grupo alquilo visivelmente aumentada a estabilidade, mas que a escolha de grupos alquilo específicos diferentes teve pouco ou nenhum efeito.
Uma parte do trabalho de Kistiakowsky envolveu uma comparação de outros compostos insaturados na forma de CH 2 = CH (CH 2 ) n-CH = CH 2 (n = 0,1,2). Esses experimentos revelaram um resultado importante; quando n = 0, há um efeito de conjugação à molécula onde o valor de ΔH é reduzido em 3,5 kcal. Isso é comparado à adição de dois grupos alquil ao etileno. Kistiakowsky também investigou sistemas de cadeia aberta, onde o maior valor de calor liberado foi encontrado durante a adição de uma molécula na posição 1,4. As moléculas cíclicas se mostraram as mais problemáticas, pois se constatou que a cepa da molécula deveria ser considerada. A deformação dos anéis de cinco membros aumentou com a diminuição do grau de insaturação. Este foi um resultado surpreendente que foi investigado posteriormente em trabalhos posteriores com anidridos de ácido cíclico e lactonas . Moléculas cíclicas como o benzeno e seus derivados também foram estudadas, pois seus comportamentos eram diferentes de outros compostos insaturados.
Apesar do rigor do trabalho de Kistiakowsky, ele não estava completo e precisava de mais evidências para respaldar suas descobertas. Seu trabalho foi um primeiro passo crucial para o início das idéias de efeitos de hiperconjugação e conjugação.
Estabilização de 1,3-butadieno e 1,3-butadieno
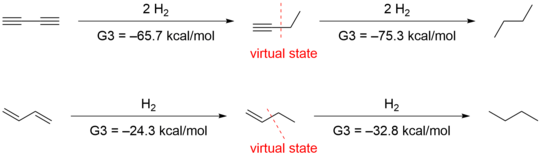
A conjugação de 1,3- butadieno foi avaliada pela primeira vez por Kistiakowsky, uma contribuição conjugativa de 3,5 kcal / mol foi encontrada com base na comparação energética da hidrogenação entre espécies conjugadas e análogos não conjugados. Rogers, que utilizou o método inicialmente aplicado por Kistiakowsky, relatou que a estabilização da conjugação de 1,3-butadino era zero, pois a diferença de Δ hyd H entre a primeira e a segunda hidrogenação era zero. Os calores de hidrogenação (Δ hyd H) foram obtidos pelo método computacional de química quântica G3 (MP2).
Outro grupo liderado por Houk sugeriu que os métodos empregados por Rogers e Kistiakowsky eram inadequados, porque as comparações de calores de hidrogenação avaliam não apenas os efeitos da conjugação, mas também outras diferenças estruturais e eletrônicas. Eles obtiveram -70,6 kcal / mol e -70,4 kcal / mol para a primeira e segunda hidrogenação, respectivamente, por cálculo ab initio , que confirmou os dados de Rogers. No entanto, eles interpretaram os dados de forma diferente levando em consideração a estabilização da hiperconjugação. Para quantificar o efeito da hiperconjugação, eles projetaram as seguintes reações isodésmicas em 1-butino e 1-buteno .
A exclusão das interações hiperconjugativas fornece estados virtuais que têm energias que são 4,9 e 2,4 kcal / mol maiores do que aquelas de 1-butino e 1-buteno , respectivamente. O emprego desses estados virtuais resulta em uma estabilização conjugativa de 9,6 kcal / mol para 1,3-butadieno e 8,5 kcal / mol para 1,3-butadieno.
Tendências em hiperconjugação
Um trabalho relativamente recente (2006) de Fernández e Frenking (2006) resumiu as tendências da hiperconjugação entre vários grupos de moléculas acíclicas, usando a análise de decomposição de energia ou EDA. Fernández e Frenking definem este tipo de análise como "... um método que usa apenas os orbitais pi dos fragmentos em interação na geometria da molécula para estimar as interações pi." Para este tipo de análise, a formação de ligações entre várias porções moleculares é uma combinação de três termos componentes. ΔE elstat representa o que Fernández e Frenking chamam de "atrações eletrostáticas quasiclássicas" de uma molécula. O segundo termo, ΔE Pauli , representa a repulsão Pauli da molécula. A orbe ΔE , o terceiro termo, representa as interações de estabilização entre orbitais e é definida como a soma de ΔE pi e ΔE sigma . A energia total de interação, ΔE int , é o resultado da soma dos 3 termos.
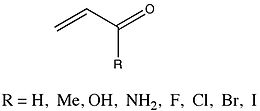
Um grupo cujos valores de ΔE pi foram analisados minuciosamente era um grupo de enonas que variavam em substituintes.
Fernández e Frenking relataram que os substituintes metil , hidroxila e amino resultaram em uma diminuição em ΔE pi do 2-propenal parental . Por outro lado, substituintes haleto de massa atômica crescente resultaram no aumento de ΔE pi . Como tanto o estudo de enona quanto a análise de Hammett estudam os efeitos dos substituintes (embora em espécies diferentes), Fernández e Frenking sentiram que comparar os dois para investigar possíveis tendências pode produzir uma visão significativa de seus próprios resultados. Eles observaram uma relação linear entre os valores de ΔE pi para os enones substituídos e as constantes de Hammett correspondentes. A inclinação do gráfico encontrada foi de -51,67, com coeficiente de correlação de -0,97 e desvio padrão de 0,54. Fernández e Frenking concluem a partir desses dados que ... "os efeitos eletrônicos dos substituintes R na conjugação pi em sistemas homo e heteroconjugados são semelhantes e, portanto, parecem ser bastante independentes da natureza do sistema de conjugação."
Barreira rotacional de etano
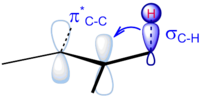
Um exemplo em que a hiperconjugação pode ser negligenciada como uma possível explicação química está na racionalização da barreira rotacional de etano (C2H6). Já era aceito na década de 1930 que as conformações escalonadas do etano eram mais estáveis do que a conformação eclipsada . Wilson havia provado que a barreira de energia entre qualquer par de conformações eclipsadas e escalonadas é de aproximadamente 3 kcal / mol, e a justificativa geralmente aceita para isso eram as interações estéricas desfavoráveis entre os átomos de hidrogênio.
Em seu artigo de 2001, no entanto, Pophristic e Goodman revelaram que essa explicação pode ser muito simplista. Goodman se concentrou em três fatores físicos principais: interações hiperconjugativas, repulsão de troca definida pelo princípio de exclusão de Pauli e interações eletrostáticas ( interações de Coulomb ). Comparando uma molécula de etano tradicional e uma molécula de etano hipotética com todas as repulsões de troca removidas, as curvas de potencial foram preparadas traçando o ângulo de torção versus energia para cada molécula. A análise das curvas determinou que a conformação escalonada não tinha conexão com a quantidade de repulsões eletrostáticas dentro da molécula. Esses resultados demonstram que as forças Coulombic não explicam as conformações escalonadas favorecidas, apesar do fato de que o alongamento da ligação central diminui as interações eletrostáticas.
Goodman também conduziu estudos para determinar a contribuição das interações vicinal (entre dois grupos metil) vs. geminal (entre os átomos em um único grupo metil) para a hiperconjugação. Em experimentos separados, as interações geminal e vicinal foram removidas e o conformador mais estável para cada interação foi deduzido.
| Interação excluída | Ângulo de torção | Conformador correspondente |
|---|---|---|
| Nenhum | 60 ° | Escalonado |
| Toda hiperconjugação | 0 ° | Eclipsado |
| Hiperconjugação vicinal | 0 ° | Eclipsado |
| Hiperconjugação geminal | 60 ° | Escalonado |
A partir desses experimentos, pode-se concluir que os efeitos hiperconjugativos deslocalizam a carga e estabilizam a molécula. Além disso, são os efeitos hiperconjugativos vicinais que mantêm a molécula na conformação escalonada. Graças a este trabalho, o seguinte modelo de estabilização da conformação escalonada de etano é agora mais aceito:
A hiperconjugação também pode explicar vários outros fenômenos cujas explicações também podem não ser tão intuitivas quanto as da barreira rotacional do etano.
A questão da barreira rotacional do etano não está resolvida dentro da comunidade científica. Uma análise dentro da teoria orbital molecular quantitativa mostra que as repulsões (estéricas) de 2-orbitais-4-elétrons são dominantes sobre a hiperconjugação. Um estudo da teoria das ligações de valência também enfatiza a importância dos efeitos estéricos.