Toxina B de Clostridium difficile - Clostridium difficile toxin B
| Toxina B | |||||||
|---|---|---|---|---|---|---|---|
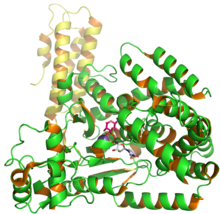 Estrutura da Toxina B de C. difficile glicosil transferase mostrando UDP e glusose da entrada 2BVM do PDB.
| |||||||
| Identificadores | |||||||
| Organismo | |||||||
| Símbolo | toxB | ||||||
| Alt. símbolos | tcdB | ||||||
| Entrez | 4914074 | ||||||
| PDB | 2BVM | ||||||
| RefSeq (Prot) | YP_001087135.1 | ||||||
| UniProt | P18177 | ||||||
| Outros dados | |||||||
| Número CE | 2.4.1.- | ||||||
| Cromossoma | genoma: 0,79 - 0,8 Mb | ||||||
| |||||||
| Domínio helicoidal N-terminal da toxina TcdB | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | TcdB_N | ||||||||
| Pfam | PF12918 | ||||||||
| |||||||||
| Domínio de glicosiltransferase catalítica TcdA / TcdB | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | TcdA_TcdB | ||||||||
| Pfam | PF12919 | ||||||||
| |||||||||
| Família Peptidase C80 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Peptidase_C80 | ||||||||
| Pfam | PF11713 | ||||||||
| InterPro | IPR020974 | ||||||||
| |||||||||
| Domínio de formação de poros TcdA / TcdB | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | TcdA_TcdB_pore | ||||||||
| Pfam | PF12920 | ||||||||
| TCDB | 1.C.57 | ||||||||
| Superfamília OPM | 199 | ||||||||
| Proteína OPM | 6oq6 | ||||||||
| |||||||||
A toxina B do Clostridium difficile é uma citotoxina produzida pela bactéria Clostridioides difficile , anteriormente conhecida como Clostridium difficile . É um dos dois principais tipos de toxinas produzidas por C. difficile , sendo a outra uma enterotoxina ( Toxina A ). Ambos são muito potentes e letais.
Estrutura
A toxina B (TcdB) é uma citotoxina que possui peso molecular de 270 kDa e ponto isoelétrico , pl, de 4,1. A toxina B tem quatro domínios estruturais diferentes: catalítico , protease de cisteína , translocação e ligação ao receptor . O domínio catalítico da glucosiltransferase N-terminal inclui os resíduos de aminoácidos 1-544, enquanto o domínio da protease de cisteína inclui os resíduos 545-801. Além disso, a região de translocação incorpora resíduos de aminoácidos de 802 a 1664, enquanto a região de ligação ao receptor faz parte da região C-terminal e inclui resíduos de aminoácidos de 1665 a 2366.
A atividade de glicosilação da toxina B ocorre na região catalítica N-terminal (resíduos 1–544). Esta região glicosila substratos independentemente de qualquer atividade citotóxica. No entanto, uma pequena deleção da região de ligação ao receptor causa atenuação da atividade da toxina B. A região de translocação contém uma estrutura tipo haste hidrofóbica, que pode ajudar os resíduos 958-1130 na formação de poros que abrangem a membrana . A região de ligação ao receptor que inclui a região repetitiva C-terminal (CRR) aumenta a interação da membrana TcdB, mas não participa da formação de poros. Além disso, a protease de cisteína e as regiões de translocação têm estruturas complexas que desempenham um papel funcional importante na translocação e na ligação ao receptor. No entanto, deletar a região de translocação dos aminoácidos diminui a atividade citotóxica em 4 vezes. Ambas as proteases de cisteína e a maioria das regiões de translocação abrigam proteínas hidrofóbicas , que mostram acesso a TcdB e outras toxinas que atravessam as membranas celulares .
Domínio de ligação ao receptor
O C-terminal de TcdB (a região verde da Fig. 2) contém uma região conhecida como oligopeptídeos repetitivos combinados (CROPs) que contém resíduos de aminoácidos 1831-2366. Esses CROPs constituem 19–24 repetições curtas (SRs) de aminoácidos, cerca de 31 repetições longas (LRs) de aminoácidos, toxina A e Toxina B. A região dos CROPs TcdB consiste em 19 SRs e 4 LRs. Esta região SRs e LRs permite a formação de motivos de ligação à parede celular que ajudam a ligar porções de açúcar das superfícies celulares.
Purificação
Para purificar a toxina B de culturas de células de C. difficile , caldo de infusão de cérebro e coração é usado porque promove a síntese da toxina B. O método de filtração facilita a purificação da toxina B do sobrenadante de C. difficile . A concentração de toxinas do sobrenadante é proporcional à contagem de células do organismo. Muitos estudos propuseram que a maioria das toxinas é liberada na fase logarítmica tardia ou nas fases estacionárias iniciais , portanto, a toxina B é secretada continuamente pelas células. Embora existam muitos métodos empregados por diferentes estudos na purificação da toxina B, a maioria dos estudos usa métodos envolvendo concentrações de sulfato de amônio ultrafiltrado ou precipitação , em vez de filtração em gel ou cromatografia de troca iônica . Além disso, a eficácia do método de cromatografia de troca iônica ajuda a diferenciar entre TcdA e TcdB.
Função
Quando o resíduo de treonina catalítica da glucosiltransferase desativa uma família de pequenas GTPases , por exemplo, a família Rho ; Rac , e Cdc42 dentro das alvo células perturbe de transdução de sinal de mecanismos, que conduz a mau funcionamento de actina do citoesqueleto , célula - junção de células , e a apoptose (Fig. 5). Rho induz a atividade das fibras de estresse de actina . As proteínas Rac controlam as atividades de ondulação da membrana e neutrófilos NADPH- oxidase . Cdc42 regula a formação do filamento F-actina em filopódios .
Citotoxicidade
Vários estudos têm demonstrado que a presença de TcdB em mamíferos células leva a alterações rápidas no âmbito célula morfologia e sinalização celular . Em pouco tempo, as células apresentam o aspecto de placas com pequenas dosagens de TcdB e TcdA. Além disso, a morte das células é o principal impacto dessas toxinas após as células terem sido intoxicadas . Uma investigação de Donta et al., Encaminhou que TcdB tem impactos graves em outras células de mamíferos, como células de ovário de hamster chinês , células epiteliais cervicais humanas , células adrenais de camundongos , hepatócitos de ratos e astrócitos de ratos (Fig.3).
A atividade citotóxica é baseada em tipos de células, que podem variar de 4 a 200 vezes. Geralmente, quando as células são infectadas com TcdB, elas não apenas perdem sua integridade estrutural, mas também diminuem os filamentos de F-actina . Os arredondamentos celulares por TcdB não demoram mais do que 2 horas (Fig. 4), mas no que diz respeito à morte celular , pode demorar cerca de 24 horas. No que diz respeito à diarreia associada ao Clostridium difficile (CDAD), os efeitos da citopatia são mais críticos do que a morte celular real porque, uma vez que as células perdem a integridade do filamento de actina do citoesqueleto , também perdem a sua função normal.

Efeitos em pequenas GTPases
A causa da atividade citotóxica por TcdB dentro da célula hospedeira é principalmente mediada por endocitose do receptor . Os endossomos ácidos permitem que a toxina B entre no citosol . Este fenômeno ocorre por uma região de receptor de ligação , que permite que a toxina entre nas células hospedeiras. Através da acessibilidade do citosol das células hospedeiras , TcdB desativa as pequenas GTPases (Fig. 5), por exemplo, os membros da família Rho Rac e Cdc42 pelo processo de glicosilação de treonina 35 em Cdc42 e Rac, e treonina 37 em Rho. Essas Rho GTPases são encontradas de forma ubíqua no citosol de células eucarióticas que são responsáveis pela organização do citoesqueleto de actina porque as toxinas no citosol causam condensação de filamentos de actina como consequência do arredondamento celular e bolha da membrana (Fig. 3), que em última análise leva à apoptose . TcdB causa mudanças críticas na dinâmica e morfologia celular . A Figura 3 mostra o provável efeito da toxina B na superfície de uma célula; bolha de membrana (setas pretas). Além disso, o TcdB inativa Rho GTPases. Como consequência, as junções célula-célula são interrompidas, o que aumenta a permeabilidade epitelial da toxina B e o acúmulo de fluido no lúmen. Este é um dos principais agentes causadores da diarreia associada ao Clostridium difficile (CDAD) (Fig. 5).

Além disso, a taxa de hidrólise por TcdB de UDP-glicose é aproximadamente cinco vezes maior do que TcdA. Vários estudos indicaram que Rho exibe modificação pós-tradução por meio de prenilação e carboximetilação, que ocorre no lado citoplasmático da membrana plasmática , daí a troca de GTP por GDP . Quando o TcdB se liga a Rho e outras pequenas GTPases , o GTP se hidrolisa em GDP , o que leva a uma ligação de GTP (ativa) a uma ligação de GDP (inativo) (Fig. 5). Além disso, essa atividade de intercâmbio é regulada por fatores guanina no citosol da célula.
Perturbação nas vias de sinal
A regulação celular de Rho, Rac e Cdc42 tem efeitos fora da vizinhança dos filamentos de actina do citoesqueleto (Fig. 4). Essas pequenas GTPases são incorporadas ao ciclo celular que regula os sinais via proteína quinase quinases ativadas por mitogênio (MAPKKs) . Algumas partes fisiológicas das células que não estão envolvidas nos filamentos de actina podem não causar arredondamento ou morte celular imediatamente, mas na atividade da via a jusante, podem levar à deterioração dos filamentos de actina e, finalmente, morte celular .
Em 1993, um estudo conduzido por Shoshan et al., Mostrou que as células com TcdB alteraram a atividade da fosfolipase A2 . Este foi um evento independente da ruptura do citoesqueleto de actina . Shoshan et ai., Também mostraram que TcdB inibiu a actividade do receptor de sinalização, desactivando as proteínas Rho através de fosfolipase D .
Formação de poros
TcdB acessa o interior da célula através da endocitose mediada por clatrina . Quando a toxina B faz parte do citosol , a glucosiltransferase passa através da membrana endossômica , que diminui o pH, induz a translocação e finalmente leva a mudanças morfológicas dos resíduos da região de translocação (958-1130 ) As regiões hidrofóbicas são incorporadas na membrana do hospedeiro para formar poros que permitem a passagem dos domínios da glucosiltransferase . Quando as células são infectadas com TcdB em um ambiente ácido, ele atenua as toxinas e causa rearranjos de forma (Fig. 6). Como consequência do pH ácido, o TcdB exibe diferenças claras na fluorescência original do triptofano , na suscetibilidade das proteases e nas superfícies hidrofóbicas . Outro grupo mostrou que a acidificação leva a mudanças conformacionais da toxina e, mais importante, ajuda a formar poros. Uma região de translocação putativa (Fig. 2) compõe aproximadamente 801–1400 aminoácidos, dos quais os resíduos 958–1130 são hidrofóbicos e são responsáveis pela formação de poros transmembrana. A maioria dos estudos usou a cepa 630 do TcdB para mostrar a atividade de formação de poros das toxinas do C. difficile .
Induzido por pH
Para ver se os efeitos da clivagem proteolítica de TcdB ocorrem na superfície celular ou em endossomos ácidos , os estudos usaram a Bafilomicina A1 , que é conhecida por bloquear as H + -ATPases tipo v dos endossomos. Isso reduz a acidez nos endossomos. A via de captação fisiológica de TcdB impede a atividade citopática de TcdB. Quando as células estavam em condições ácidas (pH 4,0) por 5 minutos após a ligação de TcdB à superfície celular a 37 graus Celsius, os rearranjos de forma e arredondamento foram observados. No entanto, quando as células arredondadas foram incubadas por mais uma hora em pH neutro (7,0) com parâmetros semelhantes, nenhum arredondamento foi observado. Ambos os estudos mostraram que a toxina B tem uma propriedade de clivagem proteolítica , que é crítica para o acesso ao citosol . Ter um endossomo de pH ácido leva a alterações topológicas de TcdB (Figura 6).
Genética
O gene que codifica a proteína TcdB, tcdB , está localizado na região cromossômica de 19,6 kb . Isso é conhecido como locus de patogenicidade ou PaLoc (Figura 2). O quadro de leitura aberta (ORF) para tcdB tem 7.098 nucleotídeos de comprimento. É importante mencionar que - além dos principais genes de toxinas na região PaLoc - existem três outros genes acessórios que codificam na região PaLoc : tcdR (L), tcdC (R) e tcdE no meio. Esses genes ajudam a regular a expressão de TcdA e TcdB. Eles também ajudam a secretar ou liberar as toxinas da célula. O gene codificador tcdE , localizado entre tcdB e tcdA, é análogo às proteínas holin , portanto, sugere-se que tcdE atue como um gene facilitador que potencializa a liberação ou secreção de TcdA e TcdB consequentemente aumentando a permeabilidade da membrana da célula hospedeira .
Detecção de toxina
Existem diferentes tamanhos de plasmídeo de C. difficile . Os pesos moleculares detectados variam de 2,7x10 6 a 100x10 6 , mas os tamanhos de plasmídeo não mostram correlação com a toxicidade . Para detectar o nível de toxina B em C. difficile , os médicos usam amplamente os ensaios de cultura de células derivados de amostras de fezes de pacientes com PMC . O ensaio de cultura de células é considerado um "padrão ouro" para detectar toxicidade em C. difficile porque uma pequena quantidade de toxina B é capaz de causar arredondamento celular (Fig. 4), portanto, é uma grande vantagem dos laboratórios clínicos fazer correlações com o CDAD causado pelo TcdB. Embora a atividade citotóxica de grandes toxinas clostridiais (LCTs) tenha sido encontrada em amostras de fezes de pacientes com PMC, a atividade da toxina B teve mais efeitos citotóxicos prejudiciais em comparação com a toxina A. Portanto, a atividade da toxina A é atenuada quando não é isolada da toxina B. A detecção da toxicidade do C. difficile é extremamente sensível, no entanto, o uso do ensaio de cultura de células permite que os laboratórios clínicos superem o desafio; usar doses tão pequenas quanto 1 pg / mL de toxina B é suficiente para causar arredondamento celular. Esta é a principal vantagem de usar o ensaio de cultura de tecidos para detectar toxicidade em pacientes com PMC . Embora laboratórios clínicos tenham tentado usar um ensaio de placa de microtitulação imunoenzimática (ELISA) e outras técnicas para detectar a atividade citotóxica da toxina B nas fezes de pacientes com PMC , os resultados não são tão precisos quanto aqueles em que ensaios de cultura de células foram usados.
Fator de produção
Ao adicionar antimicrobianos , por exemplo, clindamicina , ao meio de cultura, os estudos mostraram que a atividade citotóxica em culturas de C. difficile aumenta em 4–8 vezes. Além disso, conhecendo o papel dos antibióticos nas causas da PMC, muitos estudos anteriores se concentraram nos efeitos da produção de toxinas pelos antimicrobianos . Como resultado, os estudos foram capazes de concluir que a natureza subinibitória da vancomicina e os níveis de penicilina estavam aumentando a produção de toxinas em culturas de C. difficile . As quantidades de produção de toxinas foram correlacionadas com o uso de meio de crescimento para os organismos. Outro estudo ilustrou que os altos níveis de produção de toxinas de TcdB foram observados em meios complexos, como caldo de infusão de cérebro e coração . Altos níveis de toxinas foram produzidos com isolamento de altamente virulento . Por outro lado, baixos níveis de toxinas foram produzidos com o isolamento de fracamente virulento . Assim, mostra que as produções de toxinas foram co-reguladas. Embora o mecanismo por trás do envolvimento do ambiente na modulação dos sinais que expressam as toxinas não seja compreendido, estudos in vitro mostraram que a expressão da toxina é fortalecida pela repressão catabólica e estresse, por exemplo, antibióticos . Outro estudo mostrou que limitar a biotina em meio bem caracterizado aumenta a produção de TcdB em 64 vezes e de TcdA em 35 vezes. Isso foi feito com C. difficile e doses de biotina tão pequenas quanto 0,05 nM. Vários outros estudos iniciais argumentaram contra a teoria de que a produção de toxina tem algo a ver com o estresse ou a repressão catabólica da toxina TcdA ou TcdB. Além disso, muitos estudos dizem que a principal razão para as diferenças entre outros estudos é devido à produção de toxina não ocorrer com todos os isolados de C. difficile .
Significado clínico
Muitos estudos iniciais sugeriram que a toxina A (também conhecida como TcdA) é a principal proteína de toxina que causa diarreia associada a antibióticos (AAD); no entanto, cientistas de pesquisa na última década ou mais mostraram que a Toxina B (ou TcdB) desempenha um papel mais importante nas doenças do que qualquer um havia previsto. Com esse conhecimento, a Toxina B foi identificada como o principal fator de virulência que causa a abertura das junções apertadas das células epiteliais intestinais , o que permite que a toxina aumente a permeabilidade vascular e induza a hemorragia . Conseqüentemente, isso leva ao estabelecimento do fator de necrose tumoral α (TNF α) e das interleucinas pró - inflamatórias como os principais agentes causadores de colite pseudomembranosa (PMC) e diarreia associada a antibióticos (AAD).
O envolvimento da toxina A e - mais importante - da toxina B é o elemento chave que determina a doença causada pelo C. difficile . Os laboratórios clínicos identificaram essas toxinas nas fezes dos pacientes com base em testes de anticorpos e citotoxicidade . Foi demonstrado que essas toxinas bacterianas estão associadas à toxina hemorrágica de Clostridium sordellii (TcsH), toxina letal (TcsL) e toxina alfa de Clostridium novyi (Tcn α), tornando esta coorte a grande família de toxinas clostridiais. Por causa das semelhanças dessas toxinas com outras, os pesquisadores as classificaram como a família das grandes toxinas clostridiais (LCTs).
Mecanismo de bezlotoxumabe com TcdB
Bezlotoxumab é um anticorpo monoclonal humano desenvolvido para a prevenção da recorrência de infecções por Clostridium difficile. Por estrutura cristalizada de raios-X do terminal N de TcdB, a toxina é identificada como consistindo em três domínios: um domínio de glucosiltransferase (GTD), uma protease de cisteína e um domínio de oligopeptídeo repetitivo combinado (CROP). Bezlotoxumab liga-se especificamente a dois locais homólogos dentro do domínio CROP de TcdB. A análise estrutural por cristalografia de raios-X indica que a ligação do anticorpo oclui parcialmente os bolsos de ligação de carboidratos putativos. Consistente com esta ideia, o Bezlotoxumab bloqueia a ligação do TcdB às células dos mamíferos.
Papel na colite pseudomembranosa
Nos estágios iniciais da doença de PMC , muitos estudos especulam que o TcdA é mais potente do que o TcdB. Isso foi deduzido de experimentos in vivo em que as produções de toxinas de TcdA foram mais graves do que TcdB com cecite por antibióticos. Posteriormente, vários estudos mostraram que a TcdB desempenha um papel importante na doença de PMC e ADD. O estudo demonstrou que, embora C. difficile não produza TcdA, ainda apresenta sintomas da doença. Além disso, estudos posteriores mostraram que uma forma purificada de TcdB é uma enterotoxina mais letal em comparação com TcdA e também que o epitélio intestinal está gravemente danificado e causa uma resposta inflamatória aguda. Com uma melhor compreensão da toxina, os pesquisadores foram capazes de afirmar que TcdB é o principal fator de virulência que causa CDI sobre TcdA. No entanto, quando o TcdA está presente no intestino, ajuda a facilitar a atividade do TcdB para ter impactos mais amplos, consequentemente, afetando vários sistemas orgânicos. Além disso, quando os hamsters foram vacinados contra o TcdA, mostrou que os hamsters não estavam totalmente protegidos da doença C. difficile e isso levou os estudos a concluir que o TcdB é muito letal e potente. Além disso, a injeção de uma pequena dose de TcdA com uma dose letal de TcdB por via intravenosa ou intraperitoneal provou ser suficiente para causar a morte de um animal. Portanto, o TcdA funciona como um facilitador do TcdB saindo do intestino.