Astrócito - Astrocyte
| Astrócito | |
|---|---|
 Astrócito do cérebro de um rato cultivado em cultura de tecidos e corado com anticorpos para GFAP (vermelho) e vimentina (verde). Ambas as proteínas estão presentes em grandes quantidades nos filamentos intermediários dessa célula, de modo que a célula parece amarela. O material azul mostra DNA visualizado com coloração DAPI e revela o núcleo do astrócito e de outras células. Imagem cortesia da EnCor Biotechnology Inc.
| |
| Detalhes | |
| Localização | Cérebro e medula espinhal |
| Identificadores | |
| Latina | Astrócito |
| Malha | D001253 |
| NeuroLex ID | sao1394521419 |
| º | H2.00.06.2.00002, H2.00.06.2.01008 |
| FMA | 54537 |
|
Termos anatômicos da microanatomia | |
Astrócitos (do grego antigo ἄστρον , ástron , "estrela" + κύτος , kútos , "cavidade", "célula"), também conhecidos coletivamente como astroglia , são células gliais em forma de estrela características no cérebro e na medula espinhal . Eles desempenham muitas funções, incluindo suporte bioquímico de células endoteliais que formam a barreira hematoencefálica , fornecimento de nutrientes ao tecido nervoso, manutenção do equilíbrio de íons extracelulares, regulação do fluxo sanguíneo cerebral e um papel no processo de reparo e cicatrização do cérebro e medula espinhal após infecção e lesões traumáticas. A proporção de astrócitos no cérebro não está bem definida; dependendo da técnica de contagem usada, estudos descobriram que a proporção de astrócitos varia por região e varia de 20% a 40% de todas as glias. Outro estudo relata que os astrócitos são o tipo de célula mais numeroso no cérebro. Os astrócitos são a principal fonte de colesterol no sistema nervoso central. A apolipoproteína E transporta o colesterol dos astrócitos para os neurônios e outras células da glia, regulando a sinalização celular no cérebro. Os astrócitos em humanos são mais de vinte vezes maiores do que no cérebro de roedores e fazem contato com mais de dez vezes o número de sinapses.
Pesquisas desde meados da década de 1990 mostraram que os astrócitos propagam ondas intercelulares de Ca 2+ por longas distâncias em resposta à estimulação e, semelhante aos neurônios, liberam transmissores (chamados de gliotransmissores ) de uma maneira dependente de Ca 2+ . Os dados sugerem que os astrócitos também sinalizam para os neurônios por meio da liberação de glutamato dependente de Ca 2+ . Essas descobertas tornaram os astrócitos uma importante área de pesquisa no campo da neurociência .
Estrutura

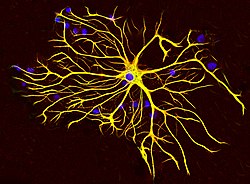
Os astrócitos são um subtipo de células gliais no sistema nervoso central . Eles também são conhecidos como células gliais astrocíticas. Em forma de estrela, seus muitos processos envolvem sinapses feitas por neurônios. Em humanos, uma única célula de astrócito pode interagir com até 2 milhões de sinapses por vez. Astrócitos são classicamente identificados usando análise histológica ; muitas dessas células expressam a proteína ácida fibrilar glial do filamento intermediário (GFAP). Existem várias formas de astrócitos no sistema nervoso central, incluindo fibroso (na substância branca), protoplasmático (na substância cinzenta) e radial . As glias fibrosas geralmente estão localizadas na substância branca, têm relativamente poucas organelas e exibem longos processos celulares não ramificados. Este tipo geralmente apresenta processos astrocíticos de endfoot que conectam fisicamente as células à parte externa das paredes capilares quando estão próximas a elas. As glias protoplasmáticas são as mais prevalentes e são encontradas no tecido da substância cinzenta, possuem maior quantidade de organelas e exibem processos terciários curtos e altamente ramificados. As células gliais radiais estão dispostas em planos perpendiculares aos eixos dos ventrículos . Um de seus processos confina com a pia-máter , enquanto o outro está profundamente enterrado na massa cinzenta. As glias radiais estão presentes principalmente durante o desenvolvimento, desempenhando um papel na migração de neurônios . As células de Müller da retina e as células da glia de Bergmann do córtex cerebelar representam uma exceção, estando presentes ainda na idade adulta. Quando nas proximidades da pia-máter, todas as três formas de astrócitos enviam processos para formar a membrana pia-glial .
Desenvolvimento
Astrócitos são células macrogliais do sistema nervoso central. Os astrócitos são derivados de populações heterogêneas de células progenitoras no neuroepitélio do sistema nervoso central em desenvolvimento. Há uma semelhança notável entre os mecanismos genéticos bem conhecidos que especificam a linhagem de diversos subtipos de neurônios e a das células macrogliais. Assim como com a especificação de células neuronais, fatores de sinalização canônicos como hedgehog sônico (SHH), fator de crescimento de fibroblastos (FGFs), WNTs e proteínas morfogenéticas ósseas (BMPs), fornecem informações posicionais para desenvolver células macrogliais por meio de gradientes de morfogênio ao longo da região dorsal-ventral, anterior –Eixo posterior e médio – lateral. O padrão resultante ao longo do neuroeixo leva à segmentação do neuroepitélio em domínios progenitores (p0, p1 p2, p3 e pMN) para tipos distintos de neurônios na medula espinhal em desenvolvimento. Com base em vários estudos, acredita-se agora que este modelo também se aplica à especificação de células macrogliais. Estudos realizados por Hochstim e colegas demonstraram que três populações distintas de astrócitos surgem dos domínios p1, p2 e p3. Esses subtipos de astrócitos podem ser identificados com base na expressão de diferentes fatores de transcrição (PAX6, NKX6.1 ) e marcadores de superfície celular ( reelin e SLIT1 ). As três populações de subtipos de astrócitos que foram identificados são 1) astrócitos VA1 localizados dorsalmente, derivados do domínio p1, expressam PAX6 e reelin 2) astrócitos VA3 ventralmente localizados, derivados de p3, expressam NKX6.1 e SLIT1 e 3) e branco intermediário - matéria localizada astrócito VA2, derivado do domínio p2, que expressa PAX6, NKX6.1, reelin e SLIT1. Depois que a especificação dos astrócitos ocorreu no desenvolvimento do SNC, acredita-se que os precursores dos astrócitos migram para suas posições finais dentro do sistema nervoso antes que ocorra o processo de diferenciação terminal .
Função
Os astrócitos ajudam a formar a estrutura física do cérebro e acredita-se que desempenhem várias funções ativas, incluindo a secreção ou absorção de transmissores neurais e a manutenção da barreira hematoencefálica. O conceito de uma sinapse tripartida foi proposto, referindo-se à estreita relação que ocorre nas sinapses entre um elemento pré-sináptico, um elemento pós-sináptico e um elemento glial.
- Estruturais : eles estão envolvidos na estruturação física do cérebro. Os astrócitos recebem esse nome porque são "em forma de estrela". São as células gliais mais abundantes do cérebro, intimamente associadas às sinapses neuronais. Eles regulam a transmissão de impulsos elétricos dentro do cérebro.
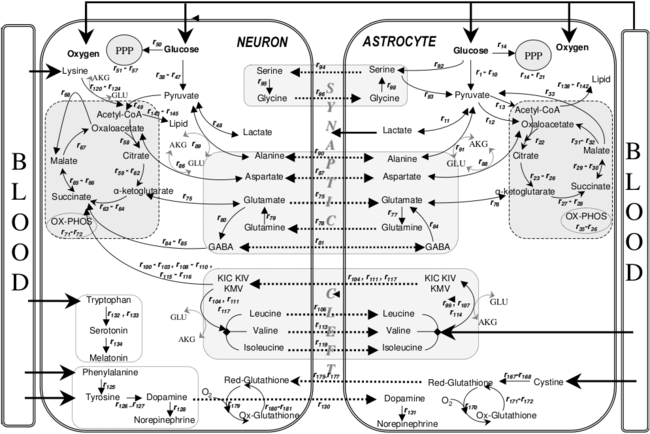
- Tampão de reserva de combustível de glicogênio : Os astrócitos contêm glicogênio e são capazes de gliconeogênese . Os astrócitos próximos aos neurônios no córtex frontal e no hipocampo armazenam e liberam glicose. Assim, os astrócitos podem abastecer os neurônios com glicose durante os períodos de alta taxa de consumo de glicose e escassez de glicose. Uma pesquisa recente em ratos sugere que pode haver uma conexão entre essa atividade e o exercício físico.
- Suporte metabólico : fornecem aos neurônios nutrientes como o lactato .
- Sensor de glicose : normalmente associado aos neurônios, a detecção dos níveis intersticiais de glicose no cérebro também é controlada pelos astrócitos. Os astrócitos in vitro tornam-se ativados por glicose baixa e in vivo esta ativação aumenta o esvaziamento gástrico para aumentar a digestão.
- Barreira hematoencefálica : pensava -se que os pés terminais dos astrócitos que circundavam as células endoteliais ajudavam na manutenção da barreira hematoencefálica , mas pesquisas recentes indicam que eles não desempenham um papel substancial; em vez disso, são as junções rígidas e a lâmina basal das células endoteliais cerebrais que desempenham o papel mais substancial na manutenção da barreira. No entanto, recentemente foi demonstrado que a atividade dos astrócitos está ligada ao fluxo sanguíneo no cérebro e que é isso que está realmente sendo medido no fMRI.
- Captação e liberação do transmissor : os astrócitos expressam transportadores da membrana plasmática, como transportadores de glutamato, para vários neurotransmissores, incluindo glutamato , ATP e GABA . Mais recentemente, foi demonstrado que os astrócitos liberam glutamato ou ATP de maneira vesicular, dependente de Ca 2+ . (Isso tem sido disputado para astrócitos do hipocampo.)
- Regulação da concentração de íons no espaço extracelular : Os astrócitos expressam canais de potássio em alta densidade. Quando os neurônios estão ativos, eles liberam potássio , aumentando a concentração extracelular local. Como os astrócitos são altamente permeáveis ao potássio, eles eliminam rapidamente o acúmulo excessivo no espaço extracelular. Se houver interferência nessa função, a concentração extracelular de potássio aumentará, levando à despolarização neuronal pela equação de Goldman . O acúmulo anormal de potássio extracelular é bem conhecido por resultar em atividade neuronal epiléptica.
- Modulação da transmissão sináptica : No núcleo supraóptico do hipotálamo , foi demonstrado que mudanças rápidas na morfologia dos astrócitos afetam a transmissão heterossináptica entre os neurônios. No hipocampo , os astrócitos suprimem a transmissão sináptica pela liberação de ATP, que é hidrolisado por ectonucleotidases para produzir adenosina . A adenosina atua nos receptores neuronais de adenosina para inibir a transmissão sináptica, aumentando assim a faixa dinâmica disponível para LTP .
- Vasomodulação : Os astrócitos podem servir como intermediários na regulação neuronal do fluxo sanguíneo.
- Promoção da atividade mielinizante dos oligodendrócitos : A atividade elétrica nos neurônios faz com que eles liberem ATP, que serve como um estímulo importante para a formação da mielina. No entanto, o ATP não atua diretamente sobre os oligodendrócitos . Em vez disso, faz com que os astrócitos secretem o fator inibidor da leucemia de citocina (LIF), uma proteína reguladora que promove a atividade mielinizante dos oligodendrócitos. Isso sugere que os astrócitos têm um papel de coordenação executiva no cérebro.
- Reparo do sistema nervoso : após lesão das células nervosas no sistema nervoso central, os astrócitos preenchem o espaço para formar uma cicatriz glial e podem contribuir para o reparo neural. O papel dos astrócitos na regeneração do SNC após uma lesão não é bem compreendido. A cicatriz glial tem sido tradicionalmente descrita como uma barreira impermeável à regeneração, implicando assim um papel negativo na regeneração do axônio. No entanto, recentemente, foi descoberto por meio de estudos de ablação genética que os astrócitos são realmente necessários para que a regeneração ocorra. Mais importante, os autores descobriram que a cicatriz do astrócito é realmente essencial para que os axônios estimulados (aqueles axônios que foram persuadidos a crescer por meio de suplementação neurotrófica) se estendam pela medula espinhal lesada. Os astrócitos que foram empurrados para um fenótipo reativo (denominado astrogliose , definida pela regulação positiva da expressão de GFAP, uma definição ainda em debate) podem na verdade ser tóxicos para os neurônios, liberando sinais que podem matar os neurônios. Ainda há muito trabalho para elucidar seu papel nas lesões do sistema nervoso.
- Potenciação de longo prazo : os cientistas debatem se os astrócitos integram aprendizagem e memória no hipocampo. Recentemente, foi demonstrado que o enxerto de células progenitoras gliais humanas nos cérebros de camundongos nascentes fará com que as células se diferenciem em astrócitos. Após a diferenciação, essas células aumentam o LTP e melhoram o desempenho da memória nos camundongos.
- Relógio circadiano : os astrócitos sozinhos são suficientes para conduzir as oscilações moleculares no SCN e o comportamento circadiano em camundongos e, portanto, podem iniciar e manter autonomamente o comportamento complexo dos mamíferos.
- A troca do sistema nervoso : com base nas evidências listadas abaixo, foi recentemente conjeturado que a macro glia (e os astrócitos em particular) atuam como um capacitor de neurotransmissor com perdas e como a troca lógica do sistema nervoso. Ou seja, a macróglia bloqueia ou permite a propagação do estímulo ao longo do sistema nervoso, dependendo de seu estado de membrana e do nível do estímulo.
| Tipo de evidência | Descrição | Referências |
|---|---|---|
| Evidência de cálcio | As ondas de cálcio aparecem apenas se uma certa concentração de neurotransmissor for excedida | |
| Evidência eletrofisiológica | Uma onda negativa aparece quando o nível de estímulo cruza um certo limite. A forma da resposta eletrofisiológica é diferente e tem a polaridade oposta em comparação com a resposta neural característica, sugerindo que outras células além dos neurônios podem estar envolvidas. |
|
| Evidência psicofísica | A resposta eletrofisiológica negativa é acompanhada por ações tudo ou nada. Uma resposta eletrofisiológica negativa moderada aparece em decisões lógicas conscientes, como tarefas de percepção. Uma onda negativa aguda e intensa aparece nas crises epilépticas e durante os reflexos. | |
| Testes de captação de glutamato baseados em radioatividade | Os testes de captação de glutamato indicam que os astrócitos processam o glutamato em uma taxa que é inicialmente proporcional à concentração de glutamato. Isso suporta o modelo de capacitor com vazamento, onde o 'vazamento' é o processamento de glutamato pela glutamina sintetase da glia. Além disso, os mesmos testes indicam um nível de saturação após o qual o nível de captação do neurotransmissor para de aumentar proporcionalmente à concentração do neurotransmissor. Este último apóia a existência de um limite. Os gráficos que mostram essas características são referidos como gráficos de Michaelis-Menten |
Os astrócitos são ligados por junções de hiato , criando um sincício eletricamente acoplado (funcional) . Devido a essa capacidade dos astrócitos de se comunicarem com seus vizinhos, as mudanças na atividade de um astrócito podem ter repercussões nas atividades de outros que estão bastante distantes do astrócito original.
Um influxo de íons Ca 2+ nos astrócitos é a mudança essencial que, em última análise, gera ondas de cálcio. Como esse influxo é causado diretamente por um aumento no fluxo sanguíneo para o cérebro, as ondas de cálcio são consideradas um tipo de função de resposta hemodinâmica . Um aumento na concentração de cálcio intracelular pode se propagar para fora através deste sincício funcional. Os mecanismos de propagação da onda de cálcio incluem a difusão de íons de cálcio e IP3 através de junções comunicantes e sinalização extracelular de ATP . As elevações de cálcio são o principal eixo conhecido de ativação em astrócitos e são necessárias e suficientes para alguns tipos de liberação de glutamato astrocítico. Dada a importância da sinalização do cálcio nos astrócitos, mecanismos reguladores rígidos para a progressão da sinalização espaço-temporal do cálcio foram desenvolvidos. Por meio de análise matemática, foi demonstrado que o influxo localizado de íons Ca 2+ produz um aumento localizado na concentração citosólica de íons Ca 2+ . Além disso, o acúmulo de Ca 2+ citosólico é independente de todo fluxo de cálcio intracelular e depende da troca de Ca 2+ através da membrana, difusão do cálcio citosólico, geometria da célula, perturbação do cálcio extracelular e concentrações iniciais.
Sinapse tripartida
No corno dorsal da medula espinhal , os astrócitos ativados têm a capacidade de responder a quase todos os neurotransmissores e, após a ativação, liberam uma infinidade de moléculas neuroativas, como glutamato , ATP , óxido nítrico (NO) e prostaglandinas (PG), que por sua vez influencia a excitabilidade neuronal. A estreita associação entre astrócitos e terminais pré - sinápticos e pós - sinápticos , bem como sua capacidade de integrar a atividade sináptica e liberar neuromoduladores, foi denominada sinapse tripartida . A modulação sináptica pelos astrócitos ocorre por causa dessa associação de três partes.
Significado clínico
Astrocitomas
Astrocitomas são tumores intracranianos primários que se desenvolvem a partir de astrócitos. Também é possível que progenitores gliais ou células-tronco neurais possam dar origem a astrocitomas. Esses tumores podem ocorrer em muitas partes do cérebro e / ou medula espinhal. Os astrocitomas são divididos em duas categorias: baixo grau (I e II) e alto grau (III e IV). Os tumores de baixo grau são mais comuns em crianças e os de alto grau são mais comuns em adultos. Astrocitomas malignos são mais prevalentes entre os homens, contribuindo para pior sobrevida.
Astrocitomas pilocíticos são tumores de grau I. Eles são considerados tumores benignos e de crescimento lento. Os astrocitomas pilocíticos freqüentemente apresentam porções císticas preenchidas com líquido e um nódulo, que é a porção sólida. A maioria está localizada no cerebelo. Portanto, a maioria dos sintomas está relacionada a dificuldades de equilíbrio ou coordenação. Eles também ocorrem com mais freqüência em crianças e adolescentes.
Astrocitomas fibrilares são tumores de grau II. Eles crescem relativamente devagar, portanto são geralmente considerados benignos, mas se infiltram no tecido saudável circundante e podem se tornar malignos . Astrocitomas fibrilares comumente ocorrem em pessoas mais jovens, que frequentemente apresentam convulsões.
Astrocitomas anaplásicos são tumores malignos de grau III. Eles crescem mais rapidamente do que os tumores de baixo grau. Os astrocitomas anaplásicos recorrem com mais frequência do que os tumores de grau inferior, porque sua tendência a se espalhar para o tecido circundante torna-os difíceis de remover completamente cirurgicamente.
O glioblastoma multiforme é um câncer de grau IV que pode se originar de astrócitos ou de um astrocitoma existente. Aproximadamente 50% de todos os tumores cerebrais são glioblastomas. Os glioblastomas podem conter vários tipos de células gliais, incluindo astrócitos e oligodendrócitos . Os glioblastomas são geralmente considerados o tipo mais invasivo de tumor glial, pois crescem rapidamente e se espalham para o tecido próximo. O tratamento pode ser complicado, porque um tipo de célula tumoral pode morrer em resposta a um tratamento específico, enquanto os outros tipos de células podem continuar a se multiplicar.
Distúrbios do neurodesenvolvimento
Os astrócitos emergiram como participantes importantes em vários distúrbios do neurodesenvolvimento . Esta visão afirma que a disfunção dos astrócitos pode resultar em circuitos neurais inadequados, que estão por trás de certos transtornos psiquiátricos, como transtornos do espectro do autismo e esquizofrenia .
Dor crônica
Em condições normais, a condução da dor começa com algum sinal nocivo seguido por um potencial de ação transportado por neurônios aferentes nociceptivos (sensores de dor), que provocam potenciais pós-sinápticos excitatórios (EPSP) no corno dorsal da medula espinhal. Essa mensagem é então retransmitida para o córtex cerebral , onde traduzimos esses EPSPs em "dor". Desde a descoberta da sinalização neurônio-astrócito, nossa compreensão da condução da dor tem sido dramaticamente complicada. O processamento da dor não é mais visto como uma transmissão repetitiva de sinais do corpo para o cérebro, mas como um sistema complexo que pode ser regulado para cima e para baixo por vários fatores diferentes. Um fator na vanguarda da pesquisa recente está na sinapse que potencializa a dor localizada no corno dorsal da medula espinhal e o papel dos astrócitos no encapsulamento dessas sinapses. Garrison e colegas de trabalho foram os primeiros a sugerir associação quando encontraram uma correlação entre hipertrofia de astrócitos no corno dorsal da medula espinhal e hipersensibilidade à dor após lesão de nervo periférico, normalmente considerada um indicador de ativação glial após lesão. Os astrócitos detectam a atividade neuronal e podem liberar transmissores químicos, que por sua vez controlam a atividade sináptica. No passado, pensava-se que a hiperalgesia era modulada pela liberação de substância P e aminoácidos excitatórios (EAA), como o glutamato , dos terminais nervosos aferentes pré-sinápticos no corno dorsal da medula espinhal. A ativação subsequente de AMPA (ácido α-amino-3-hidroxi-5-metil-4-isoxazol propiônico), NMDA (N-metil-D-aspartato) e subtipos de cainato de receptores de glutamato ionotrópicos segue. É a ativação desses receptores que potencializa o sinal de dor pela medula espinhal. Essa ideia, embora verdadeira, é uma simplificação exagerada da transdução da dor. Uma litania de outros neurotransmissores e neuromoduladores, como o peptídeo relacionado ao gene da calcitonina (CGRP), adenosina trifosfato (ATP), fator neurotrófico derivado do cérebro (BDNF), somatostatina , peptídeo intestinal vasoativo (VIP), galanina e vasopressina são todos sintetizados e liberado em resposta a estímulos nocivos . Além de cada um desses fatores regulatórios, várias outras interações entre os neurônios transmissores da dor e outros neurônios no corno dorsal aumentaram o impacto nas vias da dor.
Dois estados de dor persistente
Após lesão persistente do tecido periférico, ocorre a liberação de vários fatores do tecido lesado, bem como no corno dorsal espinhal. Esses fatores aumentam a capacidade de resposta dos neurônios de projeção de dor do corno dorsal aos estímulos subsequentes, denominados "sensibilização espinhal", ampliando assim o impulso de dor para o cérebro. A liberação de glutamato, substância P e peptídeo relacionado ao gene da calcitonina (CGRP) medeia a ativação NMDAR (originalmente silenciosa porque é obstruída por Mg2 +), auxiliando assim na despolarização dos neurônios transmissores de dor pós-sinápticos (PTN). Além disso, a ativação da sinalização IP3 e das MAPKs (proteínas quinases ativadas por mitógenos), como ERK e JNK , acarretam um aumento na síntese de fatores inflamatórios que alteram a função transportadora de glutamato. ERK também ativa AMPARs e NMDARs nos neurônios. A nocicepção é ainda sensibilizada pela associação de ATP e substância P com seus respectivos receptores (P 2 X 3 ) e receptor de neurocinina 1 (NK1R), bem como pela ativação de receptores metabotrópicos de glutamato e liberação de BDNF. A presença persistente de glutamato na sinapse eventualmente resulta na desregulação de GLT1 e GLAST , transportadores cruciais de glutamato para os astrócitos. A excitação contínua também pode induzir a ativação de ERK e JNK, resultando na liberação de vários fatores inflamatórios.
À medida que a dor nociva é sustentada, a sensibilização espinhal cria mudanças transcricionais nos neurônios do corno dorsal que levam a funções alteradas por longos períodos. A mobilização de Ca 2+ dos estoques internos resulta da atividade sináptica persistente e leva à liberação de glutamato, ATP, fator de necrose tumoral-α (TNF-α), interleucina 1β ( IL-1β ), IL-6, óxido nítrico (NO ) e prostaglandina E2 (PGE2). Os astrócitos ativados também são uma fonte de metaloproteinase 2 ( MMP2 ), que induz a clivagem da pró-IL-1β e mantém a ativação dos astrócitos. Nessa via de sinalização crônica, o p38 é ativado como resultado da sinalização de IL-1β , e há a presença de quimiocinas que ativam seus receptores. Em resposta ao dano nervoso, as proteínas de choque térmico (HSP) são liberadas e podem se ligar aos seus respectivos TLRs , levando a uma ativação posterior.
Outras patologias
Outras patologias clinicamente significativas envolvendo astrócitos incluem astrogliose e astrocitopatia . Exemplos destes incluem esclerose múltipla , neuromielite óptica anti-AQP4 + , encefalite de Rasmussen , doença de Alexander e esclerose lateral amiotrófica . Estudos têm demonstrado que os astrócitos podem ser implicado em doenças neurodegenerativas , como a doença de Alzheimer , doença de Parkinson , doença de Huntington , gagueira e esclerose lateral amiotrófica , e em lesões cerebrais agudas, tais como hemorragia intracerebral e lesão cerebral traumática.
Pesquisar
Um estudo realizado em novembro de 2010 e publicado em março de 2011 foi feito por uma equipe de cientistas da University of Rochester e da University of Colorado School of Medicine . Eles fizeram um experimento para tentar reparar o trauma no Sistema Nervoso Central de um rato adulto, substituindo as células da glia. Quando as células gliais foram injetadas na lesão da medula espinhal do rato adulto, os astrócitos foram gerados pela exposição de células precursoras gliais humanas à proteína morfogenética óssea (a proteína morfogenética óssea é importante porque é considerada a criação de arquitetura de tecido em todo o corpo). Portanto, com a combinação da proteína óssea e das células gliais humanas, eles promoveram uma recuperação significativa do posicionamento consciente do pé, do crescimento axonal e aumentos óbvios na sobrevivência neuronal nas lâminas da medula espinhal . Por outro lado, as células precursoras da glia humana e os astrócitos gerados a partir dessas células, por estarem em contato com fatores neurotróficos ciliares , não conseguiram promover a sobrevivência neuronal e o suporte do crescimento axonal no local da lesão.
Um estudo feito em Xangai teve dois tipos de culturas de neurônios do hipocampo : em uma cultura, o neurônio cresceu a partir de uma camada de astrócitos e a outra cultura não estava em contato com nenhum astrócito, mas eles foram alimentados com um meio condicionado glial (GCM) , que inibe o rápido crescimento de astrócitos em cultura no cérebro de ratos na maioria dos casos. Em seus resultados, eles puderam ver que os astrócitos tiveram um papel direto na potenciação de longo prazo com a cultura mista (que é a cultura que cresceu a partir de uma camada de astrócitos), mas não nas culturas GCM.
Estudos têm mostrado que os astrócitos desempenham uma função importante na regulação das células-tronco neurais . Uma pesquisa do Schepens Eye Research Institute em Harvard mostra que o cérebro humano é abundante em células-tronco neurais, que são mantidas em um estado dormente por sinais químicos (efrina-A2 e efrina-A3) dos astrócitos. Os astrócitos são capazes de ativar as células-tronco para que se transformem em neurônios ativos, amortecendo a liberação de efrina-A2 e efrina-A3 .
Em um estudo publicado na edição de 2011 da Nature Biotechnology, um grupo de pesquisadores da Universidade de Wisconsin relata que tem sido capaz de direcionar células- tronco embrionárias e induzidas a se tornarem astrócitos.
Um estudo de 2012 sobre os efeitos da maconha nas memórias de curto prazo descobriu que o THC ativa os receptores CB1 dos astrócitos que fazem com que os receptores do AMPA sejam removidos das membranas dos neurônios associados.
Classificação
Existem várias maneiras diferentes de classificar os astrócitos.
Linhagem e fenótipo antigênico
Isso foi estabelecido pelo trabalho clássico de Raff et al. no início da década de 1980 em nervos ópticos de ratos.
- Tipo 1: Antigenicamente Ran2 + , GFAP + , FGFR3 + , A2B5 - , assemelhando-se assim ao "astrócito tipo 1" do nervo óptico de rato no 7º dia pós-natal. Estes podem surgir das células precursoras restritas gliais tripotenciais (GRP), mas não das células bipotenciais O2A / OPC (oligodendrócito, precursor de astrócito tipo 2, também chamado célula progenitora de oligodendrócito ).
- Tipo 2: Antigenicamente A2B5 + , GFAP + , FGFR3 - , Ran 2 - . Essas células podem se desenvolver in vitro a partir do GRP tripotencial (provavelmente via estágio O2A) ou a partir de células O2A bipotenciais (que algumas pessoas {{}} pensam que podem, por sua vez, ser derivadas do GRP) ou in vivo quando essas células progenitoras são transplantadas em locais de lesão (mas provavelmente não em desenvolvimento normal, pelo menos não no nervo óptico do rato ). Os astrócitos do tipo 2 são o principal componente astrocítico em culturas de nervo óptico pós-natal que são geradas por células O2A cultivadas na presença de soro fetal de bezerro, mas não se pensa que existam in vivo .
Classificação anatômica
- Protoplasmático: encontrado na massa cinzenta e tem muitos processos de ramificação cujas extremidades envolvem as sinapses . Alguns astrócitos protoplasmáticos são gerados por células progenitoras multipotentes da zona subventricular .
- Astrócitos Gömöri-positivos. Estes são um subconjunto de astrócitos protoplasmáticos que contêm numerosas inclusões citoplasmáticas, ou grânulos, que se coram positivamente com a coloração de hematoxilina de cromo-alúmen de Gömöri . Sabe-se agora que esses grânulos são formados a partir dos restos de mitocôndrias em degeneração engolfadas nos lisossomos. Algum tipo de estresse oxidativo parece ser responsável pelo dano mitocondrial nesses astrócitos especializados. Astrócitos Gömöri-positivos são muito mais abundantes no núcleo arqueado do hipotálamo e no hipocampo do que em outras regiões do cérebro. Eles podem ter um papel na regulação da resposta do hipotálamo à glicose.
- Fibroso: encontrado na substância branca e tem processos longos e finos não ramificados cujas extremidades envolvem os nós de Ranvier . Alguns astrócitos fibrosos são gerados pela glia radial .
Classificação do transportador / receptor
- Tipo GluT: estes expressam transportadores de glutamato ( EAAT1 / SLC1A3 e EAAT2 / SLC1A2 ) e respondem à liberação sináptica de glutamato por correntes transportadoras. A função e a disponibilidade de EAAT2 são moduladas por TAAR1 , um receptor intracelular em astrócitos humanos.
- Tipo GluR: estes expressam receptores de glutamato (principalmente do tipo mGluR e AMPA ) e respondem à liberação sináptica de glutamato por correntes mediadas por canal e transientes de Ca 2+ dependentes de IP3 .
Veja também
- Gliose de Bergmann
- Gemistócito
- Pituicyte
- Lista de tipos de células humanas derivadas das camadas germinativas
Referências
Leitura adicional
- White FA, Jung H, Miller RJ (dezembro de 2007). Quimiocinas e a fisiopatologia da dor neuropática " . Anais da Academia Nacional de Ciências dos Estados Unidos da América . 104 (51): 20151–8. Bibcode : 2007PNAS..10420151W . doi : 10.1073 / pnas.0709250104 . PMC 2154400 . PMID 18083844 .
- Milligan ED, Watkins LR (janeiro de 2009). Papéis patológicos e protetores da glia na dor crônica " . Nature Reviews. Neurociências . 10 (1): 23–36. doi : 10.1038 / nrn2533 . PMC 2752436 . PMID 19096368 .
- Watkins LR, Milligan ED, Maier SF (agosto de 2001). Ativação glial: uma força motriz para a dor patológica ". Tendências em neurociências . 24 (8): 450–5. doi : 10.1016 / S0166-2236 (00) 01854-3 . PMID 11476884 . S2CID 6822068 .
- Freeman MR (novembro de 2010). "Especificação e morfogênese dos astrócitos" . Ciência . 330 (6005): 774–8. Bibcode : 2010Sci ... 330..774F . doi : 10.1126 / science.1190928 . PMC 5201129 . PMID 21051628 .
- Verkhratsky, A .; Butt, AM (2013). "Números: quantas células gliais existem no cérebro?". Glial Physiology and Pathophysiology . John Wiley and Sons. pp. 93–96. ISBN 978-0-470-97853-5.
- Ren H, Han R, Chen X, Liu X, Wan J, Wang L, Yang X, Wang J (maio de 2020). "Alvos terapêuticos potenciais para inflamação associada à hemorragia intracerebral: uma atualização" . J Cereb Blood Flow Metab . 40 (9): 1752–1768. doi : 10.1177 / 0271678X20923551 . PMC 7446569 . PMID 32423330 .