Durvalumab - Durvalumab
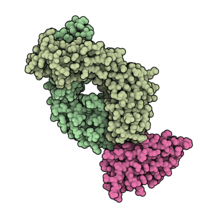
Fragmento de ligação ao antígeno de durvalumabe (verde claro) em complexo com PD-L1 (rosa). PDB : 5X8M .
| |
| Anticorpo monoclonal | |
|---|---|
| Modelo | Anticorpo inteiro |
| Fonte | Humano |
| Alvo | CD274 |
| Dados clínicos | |
| Nomes comerciais | Imfinzi |
| Outros nomes | MEDI4736, MEDI-4736 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a617030 |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Intravenoso |
| Código ATC | |
| Status legal | |
| Status legal | |
| Identificadores | |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Dados químicos e físicos | |
| Fórmula | C 6502 H 10018 N 1742 O 2024 S 42 |
| Massa molar | 146 322 0,36 g · mol -1 |
Durvalumab (nome comercial Imfinzi ) é uma imunoterapia para o câncer aprovada pela FDA , desenvolvida pela Medimmune / AstraZeneca . É um anticorpo monoclonal humano imunoglobulina G1 kappa (IgG1κ) que bloqueia a interação do ligante de morte celular programada 1 (PD-L1) com o PD-1 (CD279).
Durvalumab é conhecido como um medicamento inibidor de checkpoint .
Usos médicos
A Food and Drug Administration (FDA) dos EUA aprovou durvalumabe para certos tipos de câncer de bexiga e pulmão:
- Adultos com carcinoma urotelial localmente avançado ou metastático que apresentam progressão da doença durante ou após quimioterapia contendo platina ou progressão da doença em 12 meses de tratamento neoadjuvante ou adjuvante com quimioterapia contendo platina.
- Adultos com câncer de pulmão de células não pequenas não ressecável em Estágio III, cuja doença não progrediu após quimioterapia e radioterapia concomitantes à base de platina.
- Em combinação com etoposídeo e carboplatina ou cisplatina , como tratamento de primeira linha para adultos com câncer de pulmão de células pequenas em estágio extenso.
Testes clínicos
Um ensaio clínico de fase IB de durvalumabe e tremelimumabe mostrou alguma atividade no câncer de pulmão de células não pequenas (NSCLC). Os dados da Fase 1 na bexiga urotelial metastática avançada (Estudo 1108) levaram à designação de terapia inovadora pela FDA . Os primeiros resultados de um ensaio clínico de fase I combinando durvalumabe e gefitinibe em pacientes com câncer de pulmão "mostraram-se promissores". Um ensaio clínico de fase I está em andamento usando durvalumabe com um agonista TLR 7/8 (MEDI 9197) para tumores sólidos. Um estudo de Fase 1b / 2a está em andamento combinando durvalumabe com uma vacina de DNA de HPV (MEDI 0457) em pacientes com câncer recorrente / metastático de cabeça e pescoço associado ao HPV .
MÍSTICO
Em julho de 2017, a AstraZeneca anunciou que um ensaio de fase III de durvalumabe com tremelimumabe como tratamento de primeira linha de câncer de pulmão de células não pequenas falhou em atingir seu objetivo primário de sobrevida livre de progressão.
PACÍFICO
Em novembro de 2017, o ensaio clínico duplo-cego de fase III AstraZeneca PACIFIC demonstrou a eficácia do durvalumabe no tratamento do câncer de pulmão de células não pequenas em estágio III . 709 pacientes com NSCLC em estágio III que não tiveram progressão da doença após dois ou mais ciclos de quimioterapia à base de platina foram aleatoriamente designados para receber durvalumabe ou um placebo como terapia de consolidação para o câncer de pulmão. Durvalumabe aumentou a sobrevida livre de progressão mediana de 5,6 meses (placebo) para 16,8 meses (durvalumabe); a taxa de sobrevida livre de progressão em 12 meses aumentou de 35,3% (placebo) para 55,9% (durvalumabe), e a taxa de sobrevida livre de progressão em 18 meses aumentou de 27,0% (placebo) para 44,2% (durvalumabe). O tempo médio até a morte ou metástases à distância também aumentou de 14,6 meses (placebo) para 23,2 meses (durvalumabe). Os efeitos colaterais extremos também aumentaram de 26,1% dos pacientes (placebo) para 29,9% dos pacientes (durvalumabe).
CÁSPIO
Em março de 2021, o estudo aberto, patrocinador-cego (AstraZeneca), randomizado e controlado de fase 3 em 209 centros de tratamento de câncer em 23 países em todo o mundo (CASPIAN) demonstrou a eficácia do durvalumabe em combinação com quimioterapia à base de platina no tratamento de câncer de pulmão de pequenas células. Entre 27 de março de 2017 e 29 de maio de 2018, 972 pacientes foram selecionados e 805 foram atribuídos aleatoriamente (268 para durvalumabe mais tremelimumabe mais platina-etoposídeo, 268 para durvalumabe mais platina-etoposídeo e 269 para platina-etoposídeo). Em 27 de janeiro de 2020, o acompanhamento médio foi de 25,1 meses (IQR 22,3–27,9). Durvalumabe mais tremelimumabe mais platina-etoposídeo não foi associado a uma melhora significativa na sobrevida geral em comparação com platina-etoposídeo (razão de risco [HR] 0 · 82 [IC 95% 0 · 68–1 · 00]; p = 0 · 045); A sobrevida global mediana foi de 10,4 meses (IC 95% 9,6-12,0) versus 10,5 meses (9,3-11,2). Durvalumabe mais platina-etoposídeo mostrou melhora sustentada na sobrevida geral em comparação com platina-etoposídeo (HR 0 · 75 [IC 95% 0 · 62–0 · 91]; p nominal = 0,032); A sobrevida global mediana foi de 12,9 meses (IC 95% 11,3–14,7) versus 10,5 meses (9,3-11,2). Os eventos adversos de grau 3 ou piores por qualquer causa mais comuns foram neutropenia (85 [32%] de 266 pacientes no grupo durvalumabe mais tremelimumabe mais platina-etoposídeo, 64 [24%] de 265 pacientes no grupo durvalumabe mais platina-etoposídeo e 88 [33%] de 266 pacientes no grupo platina-etoposídeo) e anemia (34 [13%], 24 [9%] e 48 [18%]). Eventos adversos graves de qualquer causa foram relatados em 121 (45%) pacientes no grupo durvalumabe mais tremelimumabe mais platina-etoposídeo, 85 (32%) no grupo durvalumabe mais platina-etoposídeo e 97 (36%) no grupo platina- grupo etoposídeo. Mortes relacionadas ao tratamento ocorreram em 12 (5%) pacientes no grupo durvalumabe mais tremelimumabe mais platina-etoposídeo (morte, neutropenia febril e embolia pulmonar [n = 2 cada]; enterocolite, deterioração geral da saúde física e síndrome de disfunção de múltiplos órgãos, pneumonia, pneumonite e hepatite, insuficiência respiratória e morte súbita [n = 1 cada]), seis (2%) pacientes no grupo durvalumabe mais platina-etoposídeo (parada cardíaca, desidratação, hepatotoxicidade, doença pulmonar intersticial, pancitopenia e sepse [n = 1 cada]), e dois (1%) no grupo platina-etoposídeo (pancitopenia e trombocitopenia [n = 1 cada]).
Referências
links externos
- "Durvalumab" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- "Durvalumab" . NCI Drug Dictionary . Instituto Nacional do Câncer.</ref>
- "Durvalumab" . Instituto Nacional do Câncer .
