Reação exergônica - Exergonic reaction
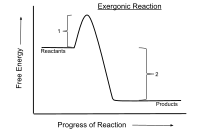
Uma reação exergônica é uma reação química em que a mudança na energia livre é negativa (há uma liberação líquida de energia livre). Isso indica uma reação espontânea se o sistema estiver fechado e as temperaturas inicial e final forem iguais. Para processos que ocorrem em um sistema fechado a pressão e temperatura constantes, a energia livre de Gibbs é usada, enquanto a energia de Helmholtz é relevante para processos que ocorrem a volume e temperatura constantes. Qualquer reação ocorrendo em temperatura constante sem entrada de energia elétrica ou fóton é exergônica, de acordo com a segunda lei da termodinâmica . Um exemplo é a respiração celular .
Simbolicamente, a liberação de energia livre, G , em uma reação exergônica (a pressão e temperatura constantes) é indicada como
Embora se diga que as reações exergônicas ocorrem espontaneamente , isso não significa que a reação ocorrerá a uma taxa observável . Por exemplo, a desproporção do peróxido de hidrogênio libera energia livre, mas é muito lenta na ausência de um catalisador adequado. Foi sugerido que ansioso seria um termo mais intuitivo neste contexto.
De maneira mais geral, os termos exergônico e endergônico se relacionam à mudança de energia livre em qualquer processo, não apenas em reações químicas. Em contraste, os termos exotérmico e endotérmico referem-se a uma mudança de entalpia em um sistema fechado durante um processo, geralmente associada à troca de calor .

