Reação de Imine Diels-Alder - Imine Diels–Alder reaction
A reação imina Diels-Alder envolve a transformação de dienos totalmente de carbono e dienófilos imina em tetra-hidropiridinas.
Introdução
As iminas podem ser empregadas como dienófilos em reações hetero-Diels-Alder. Essas reações envolvem o orbital molecular desocupado mais baixo ( LUMO ) da imina, o que significa que as iminas substituídas por grupos que retiram elétrons no nitrogênio são as mais reativas. A reação pode ser térmica, em solventes de refluxo , como benzeno ou outros típicos para reações de Diels-Alder, ou catalisada por ácido , novamente usando ácidos comuns de Diels-Alder Lewis , como trifluoreto de boro ou cloreto de zinco . Pode ocorrer por meio de um mecanismo de cicloadição combinado [4 + 2], embora em casos de polarização extrema, ocorra a adição da imina seguida por ataque nucleofílico de nitrogênio (a via "Mannich-Michael"). As iminas cíclicas, acíclicas e amarradas foram todas empregadas na reação com sucesso.
(1)

Simples de alquilo ou arilo aminas são frequentemente gerado in situ por combinação de um cloridrato de amina com um aldeído.
Mecanismo e estereoquímica
Mecanismo prevalecente
A reação de imino Diels-Alder (IDA) pode ocorrer por um processo concertado ou passo a passo. O estado de transição de energia mais baixa para o processo combinado coloca o par solitário de imina (ou ácido de Lewis coordenado) em uma posição exo . Assim, ( E ) iminas, em que o par solitário e o substituinte de carbono imina maior são cis , tendem a dar produtos exo .
(2)

Quando o nitrogênio da imina é protonado ou coordenado a um ácido de Lewis forte, o mecanismo muda para uma via gradual, Mannich-Michael.
(3)
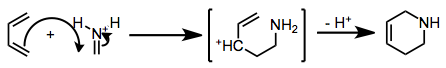
Qualquer que seja o mecanismo, o estado de transição da ciclização é altamente polarizado. Assim, a regioquímica da cicloadição pode ser prevista considerando a natureza de retirada ou doação de elétrons dos substituintes no dieno. O carbono que carrega o maior coeficiente no HOMO do dieno forma uma ligação com o carbono da imina.
(4)

Variantes estereosseletivas
Em muitos casos, os dienos cíclicos fornecem diastereosseletividades mais altas do que os dienos acíclicos. O uso de auxiliares quirais à base de aminoácidos, por exemplo, leva a boas diastereosseletividades em reações de ciclopentadieno, mas não em reações de dienos acíclicos.
(6)

Auxiliares quirais têm sido empregados no nitrogênio imino ou no carbono imino para efetuar a diastereosseleção.
(5)

Escopo e limitações
Anexar um grupo de retirada de elétrons ao nitrogênio da imina aumenta a reatividade da imina. O isômero exo geralmente predomina (particularmente quando dienos cíclicos são usados), embora as seletividades variem.
(7)

As tosiliminas podem ser geradas in situ a partir de tosilisocianato e aldeídos. As cicloadições desses intermediários com dienos dão isômeros constitucionais únicos, mas prosseguem com estereosseletividade moderada.
(8)
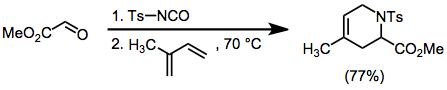
As reações de sulfonil iminas catalisadas por ácido de Lewis também exibem estereosseletividade moderada.
(9)

As iminas simples não ativadas reagem com dienos de hidrocarbonetos apenas com a ajuda de um ácido de Lewis; entretanto, tanto os dienos ricos quanto os pobres em elétrons reagem com as iminas não ativadas quando aquecidos. Os vinilcetenos, por exemplo, fornecem dihidropiridonas após [4 + 2] cicloadição com iminas. A regio e a estereosseletividade são incomumente altas nas reações dessa classe de dienos.
(10)

Os vinilalenos reagem de forma semelhante na presença de um ácido de Lewis, frequentemente com alta diastereosseletividade.
(11)

Aplicações sintéticas
A reação IDA foi aplicada à síntese de vários produtos naturais alcalóides. Neste exemplo, o dieno de Danishefsky é usado para formar um anel de seis membros a caminho do filantino.
(12)

Comparação com outros métodos
Vários outros métodos podem acessar o sistema de anel 1,2,5,6-tetrahidropiridina proporcionado pelas reações de IDA. A redução parcial de sais de piridínio foi usada, embora problemas de regiosseletividade surjam quando piridínios substituídos são usados.
(13)

Um rearranjo Ireland-Claisen modificado leva a tetrahidropiridinas por meio de um intermediário silil-ceteno acetal.
(14)

A metátese de olefina de fechamento de anel também tem sido usada para estabelecer o sistema de anel de tetra-hidropiridina.
(15)

