Escritório de Proteção à Pesquisa Humana - Office for Human Research Protections
O Office for Human Research Protections (OHRP) é um pequeno escritório dentro do Departamento de Saúde e Serviços Humanos (DHHS) dos Estados Unidos , especificamente o Gabinete do Secretário Adjunto para a Saúde no Gabinete do Secretário do DHHS, que lida com fiscalizações éticas em pesquisas clínicas conduzidas pelo Departamento, principalmente por meio do National Institutes of Health (NIH).
A principal função do escritório é a implementação de 45 CFR 46 , um conjunto de regulamentos para Comitês de Revisão Institucional (IRB) que espelha o regulamento da Food and Drug Administration (FDA) dos EUA que cobre a pesquisa clínica conduzida por empresas farmacêuticas , bem como outros regulamentos sob o orientação da Política Federal de Proteção à Pessoa Humana, também conhecida como “ Regra Comum ”.
As instituições que conduzem pesquisas patrocinadas pelo DHHS devem ter um "Federal-Wide Assurance" (FWA), um acordo com o OHRP referente à supervisão ética. OHRP também fornece educação para IRBs, dá orientação sobre ética em pesquisa e aconselha o secretário do HHS em questões de ética médica .
| Visão geral da agência | |
|---|---|
| Formado | Junho de 2000 |
| Precedente | |
| Quartel general | 1101 Wootton Parkway, Suite 200 Rockville, MD 20852 |
| Departamento de Pais | Departamento de Saúde e Serviços Humanos dos Estados Unidos |
| Local na rede Internet | https://www.hhs.gov/ohrp/ |
História
Experimentação Humana Antes do OHRP
A experimentação humana antiética nos Estados Unidos foi praticada nos Estados Unidos por um longo tempo antes da criação do OHRP. Uma das principais características da experimentação feita nessa época era o desprezo pelo sofrimento infligido aos pacientes. Na década de 1840, J. Marion Sims realizou centenas de operações cirúrgicas em mulheres escravas africanas sem usar anestesia. Robert Bartholow aplicou correntes elétricas na matéria cerebral exposta dos pacientes. Um exemplo flagrante foi em 1874, quando uma senhora veio para o tratamento de uma úlcera cancerosa em seu crânio que fez um orifício de 5 centímetros. Bartholow inseriu eletrodos em seu cérebro e causou-lhe grande angústia. A senhora entrou em coma e morreu 4 dias depois. Outro tema da experimentação humana no século 19 e no início do século 20 foi o tratamento injusto de pacientes de minorias étnicas. Na virada do século 20, os médicos do Exército dos EUA infectaram 34 prisioneiros filipinos com peste bubônica e beribéri. Entre 1932 e 1972, o experimento de sífilis de Tuskegee observou a progressão natural da sífilis em 600 homens afro-americanos (399 dos quais tinham sífilis e 201 indivíduos controle que não tinham sífilis). Em troca da participação, os homens receberam a promessa de exames médicos gratuitos, refeições quentes e um fundo funerário. Os homens nunca foram informados de que tinham sífilis, nem receberam tratamento quando a penicilina foi disponibilizada como uma cura eficaz em 1947. Ao final do estudo em 1972, apenas 74 dos indivíduos testados estavam vivos. Dos 399 homens originais com sífilis, 28 morreram da doença, 100 morreram de complicações relacionadas à sífilis. Além disso, 40 esposas foram infectadas e 19 crianças nasceram com sífilis congênita. Um equívoco comum do Experimento de Sífilis de Tuskegee é que os indivíduos foram injetados com sífilis.
Entidades de Ética em Pesquisa Precursora Notáveis
Antes da fundação do OHRP, os Estados Unidos passaram por várias entidades precursoras cujos objetivos eram tratar da ética na experimentação humana. Muitos eram comitês transitórios que duravam não mais do que um ou dois anos, como o Comitê Consultivo em Experimentos de Radiação Humana e o Conselho Consultivo de Ética. Um dos primeiros e antigos grupos preocupados com a segurança de sujeitos experimentais foi a American Psychological Association (APA), que publicou pela primeira vez seus "Padrões éticos de psicólogos" em 1953. Desde então, a APA publicou muitas versões de seu Código de Ética e atualmente opera sob o Código aprovado em 2002 A Lei Nacional de Pesquisa estabeleceu então a Comissão Nacional para a Proteção de Sujeitos Humanos de Pesquisa Biomédica e Comportamental , que foi a primeira comissão nacional cujo foco total era a proteção de sujeitos experimentais. Em 1978, a Food and Drug Administration acrescentou seus primeiros regulamentos protegendo sujeitos de pesquisa em humanos, que foram revisados em 1981. A National Bioethics Advisory Commission foi assinada pelo presidente Bill Clinton em outubro de 1995 e encerrada em outubro de 2001.
Fundador
Em 13 de junho de 2000, a Secretária de Saúde e Serviços Humanos dos Estados Unidos , Donna Shalala, criou o OHRP como um componente do Escritório de Saúde Pública e Ciência , com a função principal de supervisionar a pesquisa feita em cobaias humanas e garantir sua conformidade com regulamentos estabelecidos pelo Departamento de Saúde e Serviços Humanos dos Estados Unidos . O OHRP substituiu o Escritório de Proteção contra Riscos de Pesquisa e Greg Koski foi nomeado o primeiro diretor. O diretor do OHRP deveria se reportar ao Secretário Adjunto de Saúde dos Estados Unidos do Departamento de Saúde e Serviços Humanos (então David Satcher ).
Envolvimento de Caso
Desde sua fundação, o OHRP interferiu em diversos casos envolvendo experimentos de pesquisa com seres humanos em que foram feitas violações à saúde e aos direitos dos participantes, bem como às regulamentações estabelecidas para pesquisas em humanos. Em 2001, o OHRP suspendeu temporariamente a licença de pesquisa da Universidade Johns Hopkins e suas instalações de pesquisa associadas após a morte de um participante de um experimento de inalação de hexametônio. Descobriu-se que o experimento estava violando os regulamentos, pois os pesquisadores não informaram aos participantes sobre os possíveis perigos do hexametônio , bem como obter informações adequadas sobre o efeito do hexametônio antes da experimentação. Em outro caso ocorrido em 2013, o OHRP desafiou a prática do Teste Randomizado de Surfactante, Pressão Positiva e Oxigenação (SUPPORT), um projeto de pesquisa em que 1.300 bebês prematuros foram usados como sujeitos para testar os níveis ótimos de oxigenação a serem usados para o cuidado adequado de bebês prematuros em hospitais. Determinou-se que esse experimento violava os regulamentos federais, pois os pais dessas crianças não foram informados dos possíveis efeitos do experimento em seus filhos, que incluíam cegueira ou morte, e, portanto, não puderam dar consentimento informado .
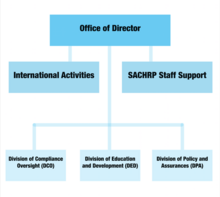
Estrutura organizacional
Escritório do Diretor
Como líder do DHHS, o Escritório do Diretor supervisiona todas as funções do OHRP e trabalha em estreita colaboração com os funcionários do DHHS, incluindo o Secretário de Saúde e Serviços Humanos e o Secretário Adjunto de Saúde para garantir que as políticas, planos e procedimentos de pesquisa em humanos atendam padrões éticos. Os comitês que se enquadram no Escritório do Diretor incluem Atividades Internacionais e o Comitê Consultivo do Secretário para a Proteção em Pesquisa em Seres Humanos (SACHRP).
Comitê Consultivo do Secretário para Proteção em Pesquisa em Seres Humanos (SACHRP)
Um comitê dentro do Gabinete do Diretor, o SACHRP consiste principalmente de pesquisadores e advogados que auxiliam o Secretário de Saúde e Serviços Humanos com seus conselhos especializados. O Subsecretário de Saúde atua como intermediário, apresentando o conselho do comitê ao Secretário para consideração. Além disso, o SACHRP também realiza três reuniões anuais abertas ao público e perguntas.
Atividades Internacionais
Este comitê trabalha para aprimorar as políticas e procedimentos éticos que protegem os sujeitos de pesquisa em humanos em todo o mundo. Esses esforços globais garantem que as pessoas que participam de qualquer pesquisa financiada e / ou conduzida pelo DHHS recebam proteção igual àquelas participantes nos Estados Unidos.
Divisão de Supervisão de Conformidade
A Divisão de Supervisão de Conformidade é responsável por avaliar relatórios de não conformidade substantivos com base nos regulamentos de Serviços Humanos e de Saúde (HHS) . Com base em relatórios de investigação escritos, o escritório determina se ações regulatórias serão necessárias para proteger os sujeitos de pesquisa em humanos. São realizadas avaliações de vigilância de conformidade com causa e sem causa.
Divisão de Educação e Desenvolvimento (DED)
O DED é responsável por grande parte da publicidade do OHRP. Suas tarefas incluem hospedar eventos, aconselhar pesquisadores envolvidos em experimentos afiliados e propagar materiais educacionais sobre a proteção de sujeitos de pesquisa em humanos. Os materiais educacionais também são apresentados online através do site oficial do OHRP.
Divisão de Política e Garantias
A Divisão de Políticas e Garantias prepara as políticas, diretrizes e requisitos para a proteção de seres humanos e fornece as informações para a comunidade de pesquisa. Também é responsável pela administração das Garantias de Conformidade em todo o território federal e pelo registro dos conselhos de revisão institucionais.
Responsabilidades
Relatório Belmont
O Office for Human Research Protections segue os princípios do Relatório Belmont para cumprir suas responsabilidades. O Relatório Belmont é um conjunto de diretrizes criado pela Comissão Nacional para a Proteção de Sujeitos Humanos de Pesquisa Biomédica e Comportamental . Com o objetivo de servir de parâmetro ético para quem realiza pesquisas envolvendo seres humanos, o Relatório Belmont apresenta três aspectos principais: limites entre prática e pesquisa, princípios éticos básicos e aplicação desses princípios.
Há uma grande diferença entre os regulamentos para a prática de procedimentos aprovados e pesquisa. Como tal, o Relatório Belmont define cada termo para ajudar a determinar o que constitui o quê. A prática é definida como uma metodologia estabelecida projetada para melhorar a condição de um indivíduo com confiança para o sucesso. A pesquisa é definida como um procedimento projetado para testar uma hipótese e tirar conclusões em um estilo experimental. O OHRP apenas analisa a atividade categorizada como pesquisa.
Os três princípios éticos básicos descritos no Relatório Belmont são respeito pelas pessoas, beneficência e justiça. O respeito pelas pessoas incorpora ênfase no sujeito e na sua autonomia, ou seja, na sua capacidade de tomar decisões na pesquisa. Para ter autonomia, os sujeitos devem dar consentimento informado. Isso significa que eles devem ser maduros o suficiente e mentalmente capazes de autodeterminação, devem compreender totalmente seu papel nos procedimentos e devem ser totalmente voluntários para participar. A beneficência requer que a pesquisa tenha intenções de produzir benefícios, ou potencial para benefícios, para o indivíduo ou outros com condições semelhantes que superem qualquer risco que possa estar envolvido. Justiça delineia a necessidade de distribuição justa na seleção dos sujeitos, o que significa que o preconceito dos participantes é minimizado. Os participantes não podem ser todos de uma população vulnerável ou facilmente acessível sem violar o princípio da justiça.
45 CFR . 46
Política HHS Básica para Proteção de Assuntos Humanos de Pesquisa
A Subparte A, ou mais comumente conhecida como “ Regra Comum ”, do 45 CFR 46 são as diretrizes fundamentais para a ética de todas as pesquisas com seres humanos. Qualquer estabelecimento que deseje fazer pesquisas envolvendo seres humanos deve enviar um documento que declare que irá cumprir esta política e todas as políticas pertinentes ao departamento federal ou agência com autoridade. O IRB deve inicialmente revisar e aprovar a pesquisa e, caso o estudo seja aprovado, o IRB continuará a monitorar a pesquisa. Se em algum ponto a pesquisa não seguir as diretrizes aprovadas pelo IRB , o IRB tem autoridade para suspender ou encerrar a pesquisa. O departamento ou agência responsável também tem o poder de suspender a pesquisa. Durante o curso do estudo, o IRB deve documentar todas as reuniões e atividades.
As diretrizes que um estudo de pesquisa deve seguir antes de ser aprovado envolve: consentimento informado dos sujeitos, risco mínimo para os sujeitos e não abuso de “sujeitos vulneráveis”. O consentimento informado deve incluir todos os aspectos da pesquisa, que incluem a premissa geral, riscos, benefícios, procedimentos alternativos, confidencialidade e quaisquer compensações que possam estar disponíveis. O sujeito deve declarar oficialmente que escolheu participar voluntariamente do experimento em todas as circunstâncias fornecidas pelo estabelecimento. Este consentimento informado é documentado pelo IRB e assinado pelo sujeito de teste.
Proteção adicional para mulheres grávidas, fetos humanos e recém-nascidos
O Departamento de Saúde e Serviços Humanos dos Estados Unidos define as condições exigidas para que qualquer pesquisa seja feita em mulheres grávidas ou fetos.
Para pesquisas em mulheres grávidas e fetos, os tópicos de doenças incluem estudos de risco pré-clínicos, minimização de risco, nenhum dinheiro (ou outros benefícios) dado para interromper a gravidez, benefício potencial direto para mulheres grávidas e fetos (caso contrário, disposições especiais de consentimento são necessárias), crianças grávidas ( requer disposições especiais de consentimento), e a incapacidade dos participantes da pesquisa de escolher nem como a gravidez será interrompida, nem se um recém-nascido (um bebê com menos de 4 semanas de idade) é viável.
Para pesquisas específicas em neonatos, os regulamentos diferem com base no fato de o bebê ter certa viabilidade, certa inviabilidade ou viabilidade incerta. Para viabilidade incerta, a pesquisa deve maximizar a probabilidade de viabilidade e obedecer às disposições de consentimento dos pais. Para neonatos não viáveis, a pesquisa não pode interromper o batimento cardíaco ou a respiração, nem pode manter artificialmente as funções vitais; não pode haver risco adicionado ao neonato, e o consentimento dos pais é necessário. Os neonatos viáveis têm um procedimento de consentimento.
Existem também condições específicas para pesquisas envolvendo placenta pós-parto, feto morto ou material fetal. Isso exige estudos para cumprir as leis federais, estaduais e locais. Além disso, se os indivíduos da pesquisa puderem ser identificados de alguma forma, esses indivíduos são sujeitos da pesquisa e devem ser tratados com todos os requisitos legais necessários.
Se um estudo não pode ser aprovado por essas condições, mas oferece grande potencial para a saúde de mulheres grávidas, fetos ou recém-nascidos, há um processo especial pelo qual o secretário pode ou não aprovar o estudo; esse processo envolve a consulta a um painel de especialistas, bem como códigos éticos e de consentimento.
Proteção adicional para prisioneiros
A Orientação sobre o envolvimento de prisioneiros em pesquisas oferece proteção aos prisioneiros. É importante observar que os presos podem se envolver em pesquisas biomédicas ou comportamentais se e somente se a pesquisa for especificamente autorizada. "Prisioneiro" é definido pelos regulamentos do HHS em 45 CFR parte 46.303 (c) como "qualquer indivíduo involuntariamente confinado ou detido em uma instituição penal. O termo se destina a abranger os indivíduos condenados a tal instituição segundo um estatuto civil ou criminal, indivíduos detidos em outras instalações em virtude de estatutos ou procedimentos de compromisso que fornecem alternativas ao processo criminal ou encarceramento em uma instituição penal, e indivíduos detidos enquanto aguardam acusação, julgamento ou sentença. " Também se aplica à situação em que uma pessoa se torna prisioneira após o início da pesquisa.
A subparte B indica que se a capacidade de um preso de dar consentimento for afetada, ou seja, a decisão desse preso não for verdadeiramente voluntária e não coagida, então salvaguardas adicionais devem ser fornecidas para fins de segurança. Além disso, os membros do IRB devem (1) geralmente não ter associação com a (s) prisão (s) envolvida (s) e (2) ter pelo menos um deles como prisioneiro. Em geral, a proteção para presidiários é semelhante à de outros grupos minoritários, e a própria pesquisa deve receber permissão do OHRP.
Proteção adicional para crianças
No caso da pesquisa em humanos, “'Crianças' são pessoas que não atingiram a idade legal para consentimento para tratamentos ou procedimentos envolvidos na pesquisa, sob a lei aplicável da jurisdição em que a pesquisa será conduzida.” Na maioria das vezes, as proteções para menores são praticamente as mesmas que para qualquer outro sujeito humano. No entanto, a Subparte D do 45 CFR 46 marca várias distinções sobre a obtenção de consentimento / assentimento e a natureza da pesquisa envolvendo crianças. De acordo com as regras reais de consentimento informado fornecidas pelo IRB para a pesquisa em questão, o consentimento da criança e o consentimento dos pais podem ser necessários para conduzir pesquisas com menores. Dependendo dos regulamentos do IRB , caso uma das partes não dê seu consentimento, a pesquisa pode não ser conduzida na criança.
Em geral, a pesquisa só pode ser feita em crianças se não oferecer risco significativo para a criança. Esta regra pode ser contornada se a criança puder obter um benefício direto para sua saúde, mesmo que o procedimento tenha um risco maior do que o mínimo. Mesmo que não haja benefício direto para o menor e possa haver risco maior do que o mínimo, o IRB pode aprovar a pesquisa se o conhecimento generalizado sobre a condição do sujeito ou se o conhecimento relativo à saúde das crianças puder resultar de pesquisas sobre a criança.
Registro do IRB
O IRB , conselho de revisão institucional, é um tipo de comitê que analisa a biopesquisa de base humana. Sob 45 CFR 46, cada IRB designado por uma instituição deve ser registrado no Office for Human Research Protections (OHRP) do Departamento de Saúde e Serviços Humanos (HHS). Ao registrar um IRB , as seguintes informações devem ser fornecidas ao OHRP: os dados da instituição, incluindo seu nome e endereço para correspondência, os dados pessoais do responsável do IRB , o número estimado de protocolos ativos que o IRB realizou uma revisão inicial ou vai realizar uma revisão, e o número de cargos de tempo integral do IRB . Todo o processo de inscrição deve ser feito eletronicamente através do site oficial do OHRP. Após o registro, todas as informações fornecidas serão analisadas pelo OHRP. O IRB permanecerá em vigor por três anos após ser oficialmente aprovado e aceito. As informações devem ser renovadas a cada três anos. Além disso, caso haja alguma alteração nas informações do presidente, uma atualização deve ser enviada ao OHRP no prazo de 90 dias. Se a instituição ou organização decidir dissolver um IRB atualmente em operação e em funcionamento , um relatório deve ser enviado ao OHRP dentro de 30 dias.
Veja também
- Experimentação humana nos Estados Unidos
- Quadro de Revisão Institucional
- Ética Médica
- Declaração de Helsinque