Papillomaviridae -Papillomaviridae
Papillomaviridae é uma família de vírus de DNA sem envelope cujos membros são conhecidos como papilomavírus. Várias centenas de espécies de papilomavírus, tradicionalmente referidos como "tipos", foram identificadas infectando todos os mamíferos cuidadosamente inspecionados, mas também outros vertebrados , como pássaros, cobras, tartarugas e peixes. A infecção pela maioria dos tipos de papilomavírus, dependendo do tipo, é assintomática (por exemplo, a maioria dos Beta-PVs) ou causa pequenos tumores benignos, conhecidos como papilomas ou verrugas (por exemplo, papilomavírus humano 1, HPV6 ou HPV11). Os papilomas causados por alguns tipos, no entanto, como o papilomavírus humano 16 e 18, apresentam o risco de se tornarem cancerígenos .
Os papilomavírus são geralmente considerados como altamente trópicos para hospedeiros e tecidos e raramente são transmitidos entre espécies. Os papilomavírus se replicam exclusivamente na camada basal dos tecidos da superfície corporal . Todos os tipos de papilomavírus conhecidos infectam uma superfície corporal específica, normalmente a pele ou o epitélio da mucosa dos órgãos genitais, ânus, boca ou vias aéreas. Por exemplo, o papilomavírus humano (HPV) tipo 1 tende a infectar a planta dos pés e o HPV tipo 2 as palmas das mãos, onde podem causar verrugas . Além disso, há descrições da presença de DNA do papilomavírus no sangue e nas células mononucleares do sangue periférico .
Os papilomavírus foram identificados pela primeira vez no início do século 20, quando foi demonstrado que as verrugas cutâneas , ou papilomas , podiam ser transmitidos entre indivíduos por um agente infeccioso filtrável. Em 1935, Francis Peyton Rous , que havia demonstrado anteriormente a existência de um vírus sarcoma causador de câncer em galinhas, passou a mostrar que um papilomavírus poderia causar câncer de pele em coelhos infectados. Esta foi a primeira demonstração de que um vírus pode causar câncer em mamíferos.
Taxonomia de papilomavírus
Existem mais de 100 espécies de papilomavírus reconhecidas, embora o ICTV reconheça oficialmente um número menor, categorizado em 53 gêneros, a partir de 2019. Todos os papilomavírus (PVs) têm organizações genômicas semelhantes, e qualquer par de PVs contém pelo menos cinco genes homólogos , embora a sequência de nucleotídeos pode divergir em mais de 50%. Algoritmos filogenéticos que permitem a comparação de homologias geraram árvores filogenéticas que possuem topologia semelhante, independente do gene analisado.
Estudos filogenéticos sugerem fortemente que os PVs normalmente evoluem junto com suas espécies hospedeiras de mamíferos e pássaros, mas radiações adaptativas , eventos zoonóticos ocasionais e recombinações também podem impactar sua diversificação. Sua organização genômica básica parece mantida por um período superior a 100 milhões de anos, e essas comparações de sequências lançaram as bases para uma taxonomia PV, que agora é oficialmente reconhecida pelo Comitê Internacional de Taxonomia de Vírus . Todos os PVs formam a família Papillomaviridae , que é distinta de Polyomaviridae , eliminando assim o termo Papovaviridae . Os ramos principais da árvore filogenética dos PVs são considerados gêneros , que são identificados por letras gregas. Ramos menores são considerados espécies e unem tipos de PV que são genomicamente distintos sem exibir diferenças biológicas conhecidas. Este novo sistema taxonômico não afeta a identificação e caracterização tradicional de "tipos" de PV e seus isolados independentes com pequenas diferenças genômicas, denominados "subtipos" e "variantes", todos os quais são táxons abaixo do nível de "espécies". Além disso, agrupamentos filogenéticos em níveis taxonômicos mais elevados têm sido propostos.
Essa classificação pode precisar de revisão à luz da existência de recombinantes de papiloma-polioma vírus. Espécies adicionais também foram descritas. O papilomavírus Sparus aurata 1 foi isolado de peixes.
Vírus do papiloma humano
Mais de 170 tipos de papilomavírus humano foram completamente sequenciados. Eles foram divididos em 5 gêneros: Alphapapillomavirus, Betapapillomavirus, Gammapapillomavirus, Mupapillomavirus e Nupapillomavirus. Foram identificados pelo menos 200 vírus adicionais que aguardam sequenciamento e classificação.
Vírus do papiloma animal
Tipos individuais de papilomavírus tendem a ser altamente adaptados à replicação em uma única espécie animal. Em um estudo, os pesquisadores limparam a pele da testa de uma variedade de animais de zoológico e usaram PCR para amplificar qualquer DNA de papilomavírus que pudesse estar presente. Embora uma grande variedade de sequências de papilomavírus tenham sido identificadas no estudo, os autores encontraram poucas evidências de transmissão entre espécies. Um zookeeper foi considerado transitoriamente positivo para uma sequência de papilomavírus específica para chimpanzés. No entanto, os autores observam que a sequência do papilomavírus específico do chimpanzé pode ter sido o resultado da contaminação da superfície da pele do tratador, em oposição à infecção produtiva.
O papilomavírus do coelho-coelho (CRPV) pode causar verrugas protuberantes em seu hospedeiro nativo, o coelho norte-americano do gênero Sylvilagus . Essas verrugas parecidas com chifres podem ser a base original para as lendas urbanas do coelho com chifre americano Jackalope e do Wolpertinger europeu . Coelhos domésticos europeus (gênero Oryctolagus ) podem ser infectados transitoriamente com CRPV em um ambiente de laboratório. No entanto, uma vez que os coelhos domésticos europeus não produzem vírus de progênie infecciosa, eles são considerados um hospedeiro incidental ou "beco sem saída" para CRPV.
A transmissão entre espécies também foi documentada para o papilomavírus bovino (BPV) tipo 1. Em seu hospedeiro natural (gado), o BPV-1 induz grandes verrugas fibrosas na pele. A infecção por BPV-1 em cavalos, que são hospedeiros incidentais do vírus, pode levar ao desenvolvimento de tumores benignos conhecidos como sarcóides . O significado agrícola do BPV-1 estimulou um esforço bem-sucedido para desenvolver uma vacina contra o vírus.
Alguns relatórios identificaram vírus do papiloma em roedores menores, como hamsters sírios , o rato multimamato africano e o camundongo da colheita da Eurásia . No entanto, não há papilomavírus conhecidos por serem capazes de infectar ratos de laboratório . A falta de um modelo de camundongo tratável para infecção por papilomavírus tem sido uma das principais limitações para investigação laboratorial de papilomavírus.
Quatro papilomavírus são conhecidos por infectar aves: Fringilla coelebs papillomavirus 1, Francolinus leucoscepus papillomavirus 1, Psittacus erithacus papillomavirus 1 e Pygoscelis adeliae papilomavirus 1. Todas essas espécies têm um gene (E9) de função desconhecida, sugerindo uma origem comum.
Evolução
A evolução dos papilomavírus é considerada lenta em comparação com muitos outros tipos de vírus, mas não há medições experimentais disponíveis atualmente. Isso provavelmente ocorre porque o genoma do papilomavírus é composto de DNA de fita dupla geneticamente estável que é replicado com alta fidelidade pelo mecanismo de replicação do DNA da célula hospedeira.
Acredita-se que os papilomavírus geralmente coevoluem com uma espécie particular de animal hospedeiro ao longo de muitos anos, embora existam fortes evidências contra a hipótese de coevolução. Em um exemplo particularmente rápido, o HPV-16 evoluiu ligeiramente à medida que as populações humanas se expandiram pelo globo e agora variam em diferentes regiões geográficas de uma forma que provavelmente reflete a história da migração humana. Os tipos cutaneotrópicos de HPV são ocasionalmente trocados entre membros da família durante toda a vida, mas outros doadores também devem ser considerados na transmissão viral.
Outros tipos de HPV, como o HPV-13, variam relativamente pouco em diferentes populações humanas. Na verdade, a sequência do HPV-13 se parece muito com um papilomavírus de bonobos (também conhecido como chimpanzés pigmeus). Não está claro se essa semelhança se deve à transmissão recente entre as espécies ou porque o HPV-13 simplesmente mudou muito pouco nos cerca de seis milhões de anos desde a divergência entre humanos e bonobos.
Estima-se que o ancestral comum mais recente desse grupo de vírus tenha existido há 424 milhões de anos .
Existem cinco gêneros principais que infectam os humanos (Alpha, Beta, Gamma, Mu e Nu). O ancestral comum mais recente desses gêneros evoluiu 49,7 milhões de anos atrás - 58,5 milhões de anos atrás . Estima-se que o ancestral mais recente do gênero gama tenha evoluído entre 45,3 milhões de anos atrás e 67,5 milhões de anos atrás .
Estrutura
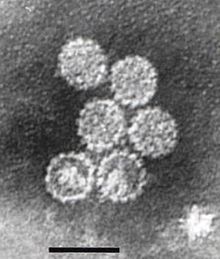
Os papilomavírus não são envelopados, o que significa que a camada externa ou cápside do vírus não é coberta por uma membrana lipídica . Uma única proteína viral, conhecida como L1, é necessária e suficiente para a formação de um capsídeo de 55-60 nanômetros composto de 72 capsômeros em forma de estrela (veja a figura). Como a maioria dos vírus não envelopados, o capsídeo é geometricamente regular e apresenta simetria icosaédrica . Partículas semelhantes a vírus auto-organizadas compostas por L1 são a base de um grupo bem-sucedido de vacinas profiláticas contra HPV projetadas para induzir anticorpos neutralizantes de vírus que protegem contra a infecção inicial por HPV. Como tal, os papilomaviridae são estáveis no meio ambiente .
O genoma do papilomavírus é uma molécula de DNA circular de fita dupla com aproximadamente 8.000 pares de bases de comprimento. É empacotado dentro do invólucro L1 junto com proteínas histonas celulares , que servem para embrulhar e condensar o DNA.
O capsídeo do papilomavírus também contém uma proteína viral conhecida como L2, que é menos abundante. Embora não esteja claro como L2 é organizado dentro do vírion, sabe-se que desempenha várias funções importantes, incluindo facilitar o empacotamento do genoma viral em vírions nascentes, bem como a entrada infecciosa do vírus em novas células hospedeiras. L2 é de interesse como um possível alvo para vacinas de proteção mais ampla contra o HPV .
O capsídeo viral consiste em 72 capsômeros, dos quais 12 são cinco coordenados e 60 são seis capsômeros coordenados, dispostos em uma estrutura de superfície icosaédrica T = 7d.
Especificidade do tecido
Os papilomavírus se replicam exclusivamente nos queratinócitos . Os queratinócitos formam as camadas mais externas da pele, bem como algumas superfícies mucosas , como a parte interna da bochecha ou as paredes da vagina. Esses tecidos superficiais, conhecidos como epitélios escamosos estratificados , são compostos de camadas empilhadas de células achatadas. As camadas celulares são formadas por um processo conhecido como diferenciação celular , no qual os queratinócitos gradualmente se especializam, formando uma superfície dura e reticulada que evita a perda de umidade e atua como uma barreira contra patógenos. Acredita-se que as células-tronco de queratinócitos menos diferenciadas, reabastecidas na camada superficial, sejam o alvo inicial de infecções produtivas por papilomavírus. As etapas subsequentes do ciclo de vida viral são estritamente dependentes do processo de diferenciação dos queratinócitos. Como resultado, os papilomavírus só podem se replicar nos tecidos da superfície corporal.
Vida útil
Entrada infecciosa
Os papilomavírus obtêm acesso às células-tronco dos queratinócitos por meio de pequenas feridas, conhecidas como microtraumas, na pele ou na superfície da mucosa. As interações entre L1 e açúcares sulfatados na superfície celular promovem a fixação inicial do vírus. O vírus é então capaz de entrar na superfície da célula por meio da interação com um receptor específico, provavelmente via integrina alfa-6 beta-4, e transportado para vesículas fechadas por membrana chamadas endossomos . A proteína L2 do capsídeo rompe a membrana do endossomo por meio de um peptídeo catiônico que penetra na célula , permitindo que o genoma viral escape e trafegue, junto com L2, para o núcleo da célula.
Persistência viral
Após a infecção bem-sucedida de um queratinócito, o vírus expressa as proteínas E1 e E2, que se destinam a replicar e manter o DNA viral como um epissoma circular . Os oncogenes virais E6 e E7 promovem o crescimento celular por meio da inativação das proteínas supressoras de tumor p53 e pRb . As células-tronco dos queratinócitos na camada basal epitelial podem manter os genomas do papilomavírus por décadas.
Produção de vírus da progênie
A expressão dos genes tardios virais, L1 e L2, é exclusivamente restrita à diferenciação de queratinócitos nas camadas mais externas da pele ou superfície mucosa. O aumento da expressão de L1 e L2 é tipicamente correlacionado com um aumento dramático no número de cópias do genoma viral. Uma vez que as camadas externas dos epitélios escamosos estratificados estão sujeitas a vigilância relativamente limitada pelas células do sistema imunológico, pensa-se que esta restrição da expressão do gene viral tardio representa uma forma de evasão imunológica.
Novos vírus de progênie infecciosa são montados no núcleo da célula . Os papilomavírus desenvolveram um mecanismo para liberar vírions no meio ambiente. Outros tipos de vírus animais sem envelope utilizam um processo lítico ativo para matar a célula hospedeira, permitindo a liberação de partículas virais descendentes. Freqüentemente, esse processo lítico está associado à inflamação , que pode desencadear um ataque imunológico contra o vírus. Os papilomavírus exploram a descamação como um mecanismo de liberação não inflamatório furtivo.
| Gênero | Detalhes do host | Tropismo de tecido | Detalhes de entrada | Detalhes de liberação | Site de replicação | Local de montagem | Transmissão |
|---|---|---|---|---|---|---|---|
| Dioxipapilomavírus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Omikronpapillomavirus | Toninhas | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyodeltapapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Omegapapilomavírus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Nupapilomavírus | Humanos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyomupapilomavírus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyozetapapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Kappapapillomavirus | Coelhos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Upsilonpapillomavirus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyoetapapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Sigmapapillomavirus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Lambdapapillomavirus | Gatos; cachorros | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Taupapilomavírus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Betapapilomavírus | Humanos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Vírus xipapiloma | Bovinos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyoepsilonpapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Tetapapilomavírus | Pássaros | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Etapapilomavírus | Pássaros | Epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Rhopapilomavírus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyothetapapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyoomikronpapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Gammapapillomavirus | Humanos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Alphapapillomavirus | Humanos; macacos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Sexo; contato |
| Zetapapilomavírus | Cavalos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Deltapapillomavirus | Ruminantes | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyolambdapapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Diosigmapapilomavírus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyorhopapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Psipapilomavírus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyokappapapillomavirus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Pipapillomavirus | Hamsters | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Iotapapilomavírus | Roedores | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Epsilonpapillomavirus | Bovinos | Epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Phipapilomavírus | Vertebrados | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyonupapilomavírus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyopipapilomavírus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Dyoiotapapilomavírus | Vertebrados | Nenhum | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
| Mupapilomavírus | Humanos | Epitelial: mucoso; epitelial: pele | Endocitose de receptor celular | Lysis | Núcleo | Núcleo | Contato |
Associação com câncer
Embora alguns tipos de papilomavírus possam causar câncer nos tecidos epiteliais que habitam, o câncer não é um resultado típico de infecção. O desenvolvimento de cânceres induzidos por papilomavírus geralmente ocorre ao longo de muitos anos. Os papilomavírus têm sido associados ao desenvolvimento de câncer cervical , câncer de pênis e câncer oral . Uma associação com câncer vulvar e carcinoma urotelial com diferenciação escamosa em pacientes com bexiga neurogênica também foi observada. Há câncer no genoma do papilomavírus que codifica duas pequenas proteínas chamadas E6 e E7, que imitam oncogenes causadores de câncer. A maneira como funcionam é que estimulam o crescimento não natural das células e bloqueiam suas defesas naturais. Também atuam em muitas proteínas de sinalização que controlam a proliferação e apoptose.
Estudo de laboratório
O fato de que o ciclo de vida do papilomavírus requer estritamente a diferenciação dos queratinócitos tem representado uma barreira substancial para o estudo dos papilomavírus em laboratório, uma vez que impediu o uso de linhas celulares convencionais para cultivar os vírus. Como os vírions infecciosos do BPV-1 podem ser extraídos das grandes verrugas que o vírus induz no gado, ele tem sido um tipo de papilomavírus modelo burro de carga por muitos anos. CRPV, papilomavírus oral de coelho (ROPV) e papilomavírus oral canino (COPV) também foram usados extensivamente para estudos laboratoriais. Assim que os pesquisadores descobriram que esses vírus causam câncer, eles trabalharam juntos para encontrar uma vacina contra ele. Atualmente, a maneira mais eficaz de fazer isso é imitar um vírus que é composto de proteína L1, mas não tem DNA. Basicamente, nosso sistema imunológico constrói defesas contra infecções, mas se essas infecções não causarem doenças, podem ser usadas como vacina. A entrada 6bt3 do PDB mostra como as superfícies dos anticorpos atacam a superfície do vírus para desativá-lo.
Alguns tipos de HPV sexualmente transmissíveis foram propagados usando um sistema de "xenoenxerto" de camundongo, no qual células humanas infectadas com HPV são implantadas em camundongos imunodeficientes . Mais recentemente, alguns grupos conseguiram isolar o HPV-16 infeccioso de lesões cervicais humanas. No entanto, o isolamento de vírions infecciosos usando esta técnica é árduo e a produção de vírus infecciosos é muito baixa.
A diferenciação de queratinócitos pode ser imitada in vitro , expondo queratinócitos cultivados a uma interface ar / líquido. A adaptação de tais sistemas de "cultura raft" ao estudo dos papilomavírus foi um avanço significativo para o estudo in vitro do ciclo de vida viral. No entanto, os sistemas de cultura de jangada são relativamente complicados e o rendimento de HPVs infecciosos pode ser baixo.
O desenvolvimento de um sistema baseado em levedura que permite a replicação epissomal estável do HPV fornece um meio conveniente, rápido e barato de estudar vários aspectos do ciclo de vida do HPV (Angeletti 2002). Por exemplo, a transcrição dependente de E2, a amplificação do genoma e a encapsidação eficiente de DNAs de HPV completos podem ser facilmente recriados em leveduras (Angeletti 2005).
Recentemente, foram desenvolvidos métodos transitórios de alto rendimento para a produção de pseudovírus do HPV com genes repórter. Embora os pseudovírus não sejam adequados para estudar certos aspectos do ciclo de vida viral, estudos iniciais sugerem que sua estrutura e entrada infecciosa inicial nas células é provavelmente semelhante em muitas maneiras aos papilomavírus autênticos.
O papilomavírus humano se liga a moléculas de heparina na superfície das células que infecta. Estudos têm demonstrado que o cristal de capsômeros L1 isolados possui as cadeias de heparina reconhecidas por sulcos de linhas de lisinas na superfície do vírus. Também aqueles com anticorpos mostram que podem bloquear esse reconhecimento.
Organização genética e expressão gênica
O genoma do papilomavírus é dividido em uma região inicial (E), que codifica seis quadros de leitura aberta (ORF) (E1, E2, E4, E5, E6 e E7) que são expressos imediatamente após a infecção inicial de uma célula hospedeira, e um região (L) que codifica uma proteína L1 do capsídeo principal e uma proteína L2 do capsídeo menor. Todas as ORFs virais são codificadas em uma fita de DNA (veja a figura). Isso representa uma diferença dramática entre papilomavírus e poliomavírus , uma vez que o último tipo de vírus expressa seus genes iniciais e tardios por transcrição bidirecional de ambas as fitas de DNA. Essa diferença foi um fator importante no estabelecimento do consenso de que papilomavírus e poliomavírus provavelmente nunca compartilharam um ancestral comum, apesar das semelhanças impressionantes nas estruturas de seus vírions.
Depois que a célula hospedeira é infectada, o promotor precoce do HPV16 é ativado e um RNA primário policistrônico contendo todas as seis ORFs iniciais é transcrito. Este RNA policistrônico contém três exons e dois introns e sofre splicing ativo de RNA para gerar múltiplas isoformas de mRNAs. Um dos RNAs isoforma spliced, E6 * I, serve como um mRNA E7 para traduzir a oncoproteína E7. Em contraste, um íntron na ORF E6 que permanece intacto sem splicing é necessário para a tradução da oncoproteína E6. No entanto, os sujeitos de transcrição precoce viral para a regulação de E2 viral e altos níveis de E2 reprimem a transcrição. Os genomas do HPV se integram ao genoma do hospedeiro pela interrupção da ORF de E2, evitando a repressão de E2 em E6 e E7. Assim, a integração do genoma viral no genoma do DNA do hospedeiro aumenta a expressão de E6 e E7 para promover a proliferação celular e a chance de malignidade.
Um importante promotor viral tardio na região viral inicial torna-se ativo apenas em células diferenciadas e sua atividade pode ser altamente aumentada pela replicação do DNA viral. O transcrito tardio também é um RNA policistrônico que contém dois íntrons e três exons. O splicing alternativo de RNA deste transcrito tardio é essencial para a expressão de L1 e L2 e pode ser regulado por elementos cis de RNA e fatores de splicing do hospedeiro.
Discussão técnica das funções do gene do papilomavírus
Genes dentro do genoma do papilomavírus são geralmente identificados após semelhança com outros genes previamente identificados. No entanto, alguns quadros de leitura aberta espúrios podem ter sido confundidos com genes simplesmente após sua posição no genoma e podem não ser genes verdadeiros. Isso se aplica especialmente a certos quadros de leitura aberta E3, E4, E5 e E8 .
E1
Codifica uma proteína que se liga à origem de replicação viral na longa região de controle do genoma viral. E1 usa ATP para exercer uma atividade helicase que separa as fitas de DNA, preparando assim o genoma viral para replicação por fatores de replicação de DNA celular .
E2
A proteína E2 serve como um regulador transcricional mestre para promotores virais localizados principalmente na região de controle longo. A proteína tem um domínio de transativação ligado por uma região de dobradiça relativamente não estruturada a um domínio de ligação de DNA bem caracterizado. E2 facilita a ligação de E1 à origem de replicação viral. E2 também utiliza uma proteína celular conhecida como Bromodomínio -4 (Brd4) para amarrar o genoma viral aos cromossomos celulares. Esta ligação à matriz nuclear da célula garante a distribuição fiel dos genomas virais para cada célula filha após a divisão celular. Pensa-se que o E2 atua como um regulador negativo da expressão dos oncogenes E6 e E7 em queratinócitos da camada basal infectados de forma latente com HPV . Mudanças genéticas, como a integração do DNA viral em um cromossomo da célula hospedeira, que inativam a expressão de E2, tendem a aumentar a expressão dos oncogenes E6 e E7, resultando em transformação celular e possivelmente mais desestabilização genética.
E3
Este pequeno gene putativo existe apenas em alguns tipos de papilomavírus. O gene não é conhecido por ser expresso como uma proteína e não parece ter nenhuma função.
E4
Embora as proteínas E4 sejam expressas em níveis baixos durante a fase inicial da infecção viral, a expressão de E4 aumenta dramaticamente durante a fase final da infecção. Em outras palavras, sua denominação "E" pode ser um nome impróprio. No caso do HPV-1, o E4 pode representar até 30% da proteína total na superfície de uma verruga. Acredita-se que a proteína E4 de muitos tipos de papilomavírus facilite a liberação do vírion no meio ambiente ao romper os filamentos intermediários do citoesqueleto dos queratinócitos . Mutantes virais incapazes de expressar E4 não suportam a replicação de alto nível do DNA viral, mas ainda não está claro como E4 facilita a replicação do DNA. E4 também demonstrou participar na captura de células na fase G2 do ciclo celular .
E5
As E5 são proteínas pequenas e muito hidrofóbicas que desestabilizam a função de muitas proteínas de membrana na célula infectada. A proteína E5 de alguns tipos de papilomavírus animal (principalmente papilomavírus bovino tipo 1) funciona como um oncogene principalmente ativando a sinalização de promoção de crescimento celular de receptores de fator de crescimento derivados de plaquetas . As proteínas E5 do papilomavírus humano associadas ao câncer, entretanto, parecem ativar a cascata de sinal iniciada pelo fator de crescimento epidérmico após a ligação do ligante. HPV16 E5 e HPV2 E5 também mostraram regular negativamente a expressão de superfície de proteínas de classe I do complexo principal de histocompatibilidade , o que pode impedir que a célula infectada seja eliminada por células T killer .
E6
E6 é um peptídeo de 151 aminoácidos que incorpora um motivo do tipo 1 com uma sequência de consenso - (T / S) - (X) - (V / I) -COOH. Ele também tem dois motivos de dedo de zinco .
E6 é de particular interesse porque parece ter várias funções na célula e interagir com muitas outras proteínas. Seu papel principal, entretanto, é mediar a degradação da p53 , uma importante proteína supressora de tumor , reduzindo a capacidade da célula de responder ao dano ao DNA .
E6 também demonstrou ter como alvo outras proteínas celulares, alterando assim várias vias metabólicas . Um desses alvos é o NFX1-91 , que normalmente reprime a produção de telomerase , uma proteína que permite que as células se dividam um número ilimitado de vezes. Quando NFX1-91 é degradado por E6, os níveis de telomerase aumentam, inativando um mecanismo principal que mantém o crescimento celular sob controle. Além disso, E6 pode atuar como um cofator de transcrição - especificamente, um ativador de transcrição - ao interagir com o fator de transcrição celular, E2F1 / DP1.
E6 também pode se ligar a domínios PDZ , sequências curtas que são frequentemente encontradas em proteínas de sinalização. O motivo estrutural de E6 permite a interação com domínios PDZ em genes supressores de tumor DLG (discos grandes) e hDLG (Drosophila grandes). A ligação nesses locais causa a transformação da proteína DLG e a interrupção de sua função supressora. As proteínas E6 também interagem com as proteínas MAGUK (família guanilato quinase associada à membrana). Essas proteínas, incluindo MAGI-1, MAGI-2 e MAGI-3 são geralmente proteínas estruturais e podem ajudar na sinalização. Mais significativamente, acredita-se que eles estejam envolvidos com a atividade de supressão de DLG. Quando o E6 se complexifica com os domínios PDZ nas proteínas MAGI, ele distorce sua forma e, portanto, impede sua função. No geral, a proteína E6 serve para impedir a atividade normal da proteína de modo a permitir que uma célula cresça e se multiplique na taxa aumentada característica do câncer.
Uma vez que a expressão de E6 é estritamente necessária para a manutenção de um fenótipo maligno em cânceres induzidos por HPV, é um alvo atraente de vacinas terapêuticas contra HPV destinadas a erradicar tumores de câncer cervical estabelecidos.
E7
Na maioria dos tipos de papilomavírus, a função primária da proteína E7 é inativar membros da família pRb de proteínas supressoras de tumor. Junto com E6, E7 serve para prevenir a morte celular ( apoptose ) e promover a progressão do ciclo celular , preparando a célula para a replicação do DNA viral. E7 também participa da imortalização de células infectadas pela ativação da telomerase celular . Como o E6, o E7 é objeto de intenso interesse de pesquisa e acredita-se que exerça uma ampla variedade de outros efeitos nas células infectadas. Tal como acontece com E6, a expressão contínua de E7 é necessária para a sobrevivência de linhas de células cancerosas, como HeLa , que são derivadas de tumores induzidos por HPV.
E8
Apenas alguns tipos de papilomavírus codificam uma proteína curta do gene E8. No caso do BPV-4 (papilomavírus gênero Xi ), o quadro de leitura aberto E8 pode substituir o quadro de leitura aberto E6, que está ausente neste gênero de papilomavírus. Esses genes E8 são química e funcionalmente semelhantes aos genes E5 de alguns vírus do papiloma humano e também são chamados de E5 / E8.
L1
L1 espontaneamente se auto-monta em capsômeros pentaméricos. Os capsômeros purificados podem continuar a formar capsídeos, que são estabilizados por ligações dissulfeto entre as moléculas L1 vizinhas. Os capsídeos L1 montados in vitro são a base das vacinas profiláticas contra vários tipos de HPV. Em comparação com outros genes do papilomavírus, as sequências de aminoácidos da maioria das porções de L1 são bem conservadas entre os tipos. No entanto, as alças de superfície de L1 podem diferir substancialmente, mesmo para membros diferentes de uma espécie particular de papilomavírus. Isso provavelmente reflete um mecanismo de evasão de respostas de anticorpos neutralizantes provocadas por infecções anteriores por papilomavírus.
L2
L2 existe em um estado oxidado dentro do vírion do papilomavírus, com os dois resíduos de cisteína conservados formando uma ligação dissulfeto intramolecular . Além de cooperar com L1 para empacotar o DNA viral no vírion, L2 demonstrou interagir com várias proteínas celulares durante o processo de entrada infecciosa. Após a ligação inicial do vírion à célula, L2 deve ser clivada pela protease furina celular . O vírion é internalizado, provavelmente por meio de um processo mediado por clatrina, em um endossomo, onde condições ácidas podem levar à exposição de porções de L2 que desestabilizam a membrana. As proteínas celulares beta- actina e sintaxina -18 também podem participar em eventos de entrada mediados por L2. Após o escape do endossomo, L2 e o genoma viral são importados para o núcleo da célula, onde trafegam para um domínio subnuclear conhecido como corpo ND-10 , que é rico em fatores de transcrição . Pequenas porções de L2 são bem conservadas entre diferentes tipos de papilomavírus, e vacinas experimentais direcionadas a esses domínios conservados podem oferecer proteção contra uma ampla gama de tipos de HPV.
Veja também
Referências
links externos
- ICTV Report Papillomaviridae
- Zona viral : Papillomaviridae
- O Laboratório Nacional de Los Alamos mantém um banco de dados de sequências de papilomavírus abrangente (embora um tanto datado) . Este banco de dados útil fornece descrições detalhadas e referências para vários tipos de papilomavírus.
- Um curto vídeo que mostra os efeitos do papilomavírus na pele de um homem indonésio com epidermodisplasia verruciforme , a incapacidade genética de se defender contra alguns tipos de HPV cutâneo.
- [2] de Villiers, EM, Bernard, HU, Broker, T., Delius, H. e zur Hausen, H. Index of Viruses - Papillomaviridae (2006). In: ICTVdB - The Universal Virus Database, versão 4. Büchen-Osmond, C (Ed), Columbia University, Nova York, EUA.
- 00.099. Descrição de Papillomaviridae em: ICTVdB - The Universal Virus Database, versão 4. Büchen-Osmond, C. (Ed), Columbia University, Nova York, EUA
- Partícula do papilomavírus humano e visualização do genoma
- ICTV