Ensaio de ligação de ligante - Ligand binding assay
Um ensaio de ligação de ligante ( LBA ) é um ensaio , ou um procedimento analítico, que se baseia na ligação de moléculas de ligante a receptores , anticorpos ou outras macromoléculas . Um método de detecção é usado para determinar a presença e extensão dos complexos ligante-receptor formados, e isso geralmente é determinado eletroquimicamente ou através de um método de detecção de fluorescência . Este tipo de teste analítico pode ser usado para testar a presença de moléculas alvo em uma amostra que se liga ao receptor.
Existem vários tipos de ensaios de ligação de ligantes, tanto radioativos quanto não radioativos. Como tal, os ensaios de ligação de ligante são um superconjunto de ensaios de radioligação , que são o inverso conceitual dos radioimunoensaios (RIA). Alguns tipos mais novos são chamados de ensaios "misturar e medir" porque não exigem a separação do ligante ligado do não ligado.
Os ensaios de ligação de ligando são usados principalmente em farmacologia para várias demandas. Especificamente, apesar dos receptores endógenos , hormônios e outros neurotransmissores do corpo humano , os farmacologistas utilizam ensaios para criar drogas que são seletivas, ou mimetizam, os componentes celulares encontrados endogenamente. Por outro lado, tais técnicas também estão disponíveis para criar antagonistas do receptor a fim de prevenir outras cascatas. Esses avanços fornecem aos pesquisadores a capacidade não apenas de quantificar hormônios e receptores hormonais, mas também de contribuir com informações farmacológicas importantes no desenvolvimento de medicamentos e planos de tratamento.
História
Historicamente, as técnicas de ensaio de ligação de ligante foram amplamente utilizadas para quantificar as concentrações de hormônio ou receptor de hormônio no plasma ou no tecido. A metodologia de ensaio de ligação de ligante quantificou a concentração do hormônio no material de teste, comparando os efeitos da amostra de teste com os resultados de várias quantidades de proteína conhecida ( ligante ).
As bases para a construção do ensaio de ligação ao ligante são resultado de Karl Landsteiner , em 1945, e de seu trabalho com a imunização de animais por meio da produção de anticorpos para determinadas proteínas. O trabalho de Landsteiner demonstrou que a tecnologia de imunoensaio permitiu que os pesquisadores analisassem em nível molecular. O primeiro ensaio de ligação de ligante com sucesso foi relatado em 1960 por Rosalyn Sussman Yalow e Solomon Berson . Eles investigaram a interação de ligação da insulina com um anticorpo específico para a insulina, além de desenvolver o primeiro radioimunoensaio (RIA) para a insulina. Essas descobertas forneceram informações preciosas sobre a sensibilidade e a especificidade dos hormônios protéicos encontrados nos fluidos à base de sangue. Yalow e Berson receberam o Prêmio Nobel de Medicina como resultado de seus avanços. Por meio do desenvolvimento da tecnologia RIA, os pesquisadores foram capazes de ir além do uso de radioatividade e, em vez disso, usar ensaios de fase líquida e sólida, competitivos e imunorradiométricos. Como resultado direto dessas descobertas monumentais, os pesquisadores continuaram o avanço dos ensaios de ligação de ligantes em muitas facetas nos campos da biologia, química e semelhantes.
Formulários
Os ensaios de ligação de ligante fornecem uma medida das interações que ocorrem entre duas moléculas, como ligações de proteínas, bem como o grau de afinidade (fraca, forte ou sem conexão) para a qual os reagentes se ligam. Os aspectos essenciais dos ensaios de ligação incluem, mas não estão limitados a, o nível de concentração dos reagentes ou produtos ( consulte a seção radioativa ), mantendo o equilíbrio constante dos reagentes ao longo do ensaio e a confiabilidade e validade das reações ligadas. Embora os ensaios de ligação sejam simples, eles não fornecem informações sobre se o composto testado afeta ou não a função do alvo.
Ensaios de radioligando
Os radioligandos são usados para medir a ligação do ligante aos receptores e, idealmente, devem ter alta afinidade, baixa ligação não específica, alta atividade específica para detectar baixas densidades do receptor e especificidade do receptor.
Os níveis de radioatividade para um radioligando (por mole) são referidos como a atividade específica (SA), que é medida em Ci / mmol. A concentração real de um radioligando é determinada pela mistura de estoque específica para a qual o radioligando se originou (dos fabricantes). A seguinte equação determina a concentração real:
Ligação de saturação
A análise de saturação é usada em vários tipos de tecidos, como frações de plasma parcialmente purificado de homogenatos de tecido , células transfectadas com receptores clonados e células que estão em cultura ou isoladas antes da análise. A análise de ligação de saturação pode determinar a afinidade e densidade do receptor. Requer que a concentração escolhida seja determinada empiricamente para um novo ligante.
Existem duas estratégias comuns que são adotadas para este tipo de experimento: aumentar a quantidade de radioligando adicionado, mantendo a atividade específica constante e a concentração constante de radioligando, ou diminuindo a atividade específica do radioligando devido à adição de um ligante não marcado.
Enredo de Scatchard
Um gráfico de Scatchard ( gráfico de Rosenthal) pode ser usado para mostrar a afinidade do radioligando. Neste tipo de gráfico, a proporção de radioligando limite / livre é traçada em relação ao radioligando limite. A inclinação da linha é igual ao recíproco negativo da constante de afinidade (K). A interceptação da linha com o eixo X é uma estimativa de Bmax. O gráfico de Scatchard pode ser padronizado em relação a uma referência apropriada para que possa haver uma comparação direta da densidade do receptor em diferentes estudos e tecidos. Este gráfico de amostra indica que o radioligando se liga com uma única afinidade. Se o ligante tivesse se ligado a vários locais com diferentes afinidades de radioligando, o gráfico de Scatchard teria mostrado uma linha côncava .
Ajuste de curva não linear
Programas de ajuste de curva não linear, como Equilibrium Binding Data Analysis (EBDA) e LIGAND, são usados para calcular estimativas de parâmetros de ligação de experimentos de saturação e competição. O EBDA realiza a análise inicial, que converte a radioatividade medida em concentrações molares e cria encostas de Hill e transformações de Scatchard a partir dos dados. A análise feita por EBDA pode então ser usada por LIGAND para estimar um modelo específico para a ligação.
Vinculação de competição
A ligação por competição é usada para determinar a presença de seletividade para um ligante particular para subtipos de receptor, o que permite a determinação da densidade e proporção de cada subtipo no tecido. As curvas de competição são obtidas plotando a ligação específica, que é a porcentagem da ligação total, contra a concentração logarítmica do ligante competidor. Uma curva de competição íngreme é geralmente indicativa de ligação a uma única população de receptores, enquanto uma curva rasa, ou uma curva com pontos de inflexão claros, é indicativa de múltiplas populações de sítios de ligação.
Ensaios de ligação não radioativa
Apesar das diferentes técnicas usadas para ensaios não radioativos, eles exigem que os ligantes exibam características de ligação semelhantes ao seu equivalente radioativo. Assim, os resultados em ensaios não radioativos e radioativos permanecerão consistentes. Uma das maiores diferenças entre os ensaios de ligantes radioativos e não radioativos diz respeito aos perigos para a saúde humana. Os ensaios radioativos são prejudiciais porque produzem resíduos radioativos; ao passo que os ensaios de ligantes não radioativos utilizam um método diferente para evitar a produção de resíduos tóxicos. Esses métodos incluem, mas não estão limitados a, polarização de fluorescência (FP), transferência de energia de ressonância de fluorescência (FRET) e ressonância de plasma de superfície (SPR). A fim de medir o processo de ligação ligante-receptor, a maioria dos métodos não radioativos requerem que a marcação evite interferir nas interações moleculares.
Polarização de fluorescência
Polarização de fluorescência (FP) é sinônimo de anisotropia de fluorescência . Este método mede a mudança na velocidade de rotação de um ligante marcado com fluorescência, uma vez que é ligado ao receptor. A luz polarizada é usada para excitar o ligante e a quantidade de luz emitida é medida. A despolarização da luz emitida depende da ligação do ligante (por exemplo, ao receptor). Se o ligante não estiver ligado, ele terá uma grande despolarização (o ligante está livre para girar rapidamente, girando a luz). Se o ligante estiver ligado, o tamanho maior combinado resulta em rotação mais lenta e, portanto, despolarização reduzida. Uma vantagem desse método é que ele requer apenas uma etapa de rotulagem. No entanto, este método é menos preciso em baixas concentrações nanomolares .
Transferência de energia de ressonância de fluorescência
A Transferência de Energia por Ressonância de Fluorescência (FRET) utiliza a energia transferida entre o doador e as moléculas aceitadoras que estão nas proximidades. FRET usa um ligante marcado com fluorescência, como com FP. A transferência de energia dentro do FRET começa estimulando o doador. A interação dipolo-dipolo entre o doador e a molécula aceitadora transfere a energia do doador para a molécula aceitadora. Se o ligante estiver ligado ao complexo receptor-anticorpo, o aceitador emitirá luz. Ao usar FRET, é fundamental que haja uma distância menor que 10 nm entre o aceitador e doador, além de um espectro de absorção sobreposto entre o aceitador e doador, e que o anticorpo não interfira ou bloqueie o local de ligação do ligante.
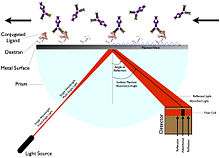
Ressonância de plasmão de superfície
A ressonância de plasma de superfície (SPR) não requer marcação do ligante. Em vez disso, ele funciona medindo a mudança no ângulo em que a luz polarizada é refletida de uma superfície ( índice de refração ). O ângulo está relacionado à mudança na massa ou camada de espessura, como a imobilização de um ligante alterando o ângulo de ressonância, o que aumenta a luz refletida. O dispositivo para o qual o SPR é derivado inclui um chip sensor, uma célula de fluxo, uma fonte de luz, um prisma e um detector de posição de ângulo fixo.
Ensaios de ligação de fase líquida
Imunoprecipitação
O ensaio de ligação ao ligante de fase líquida de imunoprecipitação (IP) é um método que é usado para purificar ou enriquecer uma proteína específica, ou um grupo de proteínas, usando um anticorpo de uma mistura complexa. O extrato de tecido ou células rompidas é misturado com um anticorpo contra o antígeno de interesse, que produz o complexo antígeno-anticorpo. Quando a concentração de antígeno é baixa, a precipitação do complexo antígeno-anticorpo pode levar horas ou até dias e torna-se difícil isolar a pequena quantidade de precipitado formado.
O ensaio de imunoabsorção enzimática ( ELISA ) ou Western blotting são duas maneiras diferentes pelas quais o antígeno purificado (ou múltiplos antígenos) pode ser obtido e analisado. Este método envolve a purificação de um antígeno com a ajuda de um anticorpo anexado em um suporte sólido (com esferas), como a resina de agarose. O complexo de proteínas imobilizadas pode ser realizado em uma única etapa ou sucessivamente.
O IP também pode ser usado em conjunto com a marcação de radioisótopos biossintéticos. Usando essa combinação de técnicas, pode-se determinar se um antígeno específico é sintetizado por um tecido ou por uma célula.
Ensaios de ligação de fase sólida
Placa multipoços
As placas Multiwell são placas de petri múltiplas incorporadas em um recipiente, com o número de poços individuais variando de 6 a mais de 1536. Os ensaios da placa Multiwell são convenientes para lidar com as dosagens e repetições necessárias. Há uma ampla variedade de tipos de placas que possuem uma pegada padronizada, equipamentos de suporte e sistemas de medição. Eletrodos podem ser integrados na parte inferior das placas para capturar informações como resultado dos ensaios de ligação. Os reagentes de ligação ficam imobilizados na superfície do eletrodo e podem ser analisados.
As placas de múltiplos poços são fabricadas para permitir que os pesquisadores criem e manipulem diferentes tipos de ensaios (ou seja, bioensaios , imunoensaios , etc.) dentro de cada placa de múltiplos poços. Devido à variabilidade na formatação da placa de múltiplos poços, não é incomum o surgimento de artefatos. Os artefatos são devidos aos diferentes ambientes encontrados nos diferentes poços da placa, especialmente próximo às bordas e ao centro dos poços. Esses efeitos são também conhecidos como efeitos, efeitos de borda e efeitos de placa. Assim, enfatizando a necessidade de posicionar os designs de ensaio da maneira correta dentro e entre cada placa.
O uso de placas de múltiplos poços é comum ao medir a atividade de ensaio biológico in vitro ou medir a imunorreatividade por meio de imunoensaios. Os artefatos podem ser evitados mantendo-se a uniformidade da placa, aplicando-se a mesma dose do meio específico em cada poço, além de manter a pressão atmosférica e as taxas de temperatura para reduzir a umidade.
Encadernação no cordão
Os ensaios de ligação de ligante em esferas são métodos de isolamento para proteínas básicas, DNA / RNA ou outras biomoléculas localizadas em suspensões indefinidas e podem ser usados em várias aplicações biocromatográficas. Ligantes bioafinos são covalentemente ligados a grânulos de sílica com grupos de silanol carregados negativamente terminais ou grânulos de poliestireno e são usados para isolamento e purificação de proteínas básicas ou adsorção de biomoléculas. Após a ligação, a separação é realizada por centrifugação (separação por densidade) ou por atração por campo magnético (apenas para partículas magnéticas). As contas podem ser lavadas para fornecer pureza da molécula isolada antes de dissolvê-la por métodos de troca iônica. Os métodos de análise direta baseados na detecção enzimática / fluorescente (por exemplo, HRP, corante fluorescente) podem ser usados para determinação on-bead ou quantificação de biomoléculas ligadas.
Ligação na coluna
Filtro
Os ensaios de filtro são um ensaio de ligação de ligante de fase sólida que usa filtros para medir a afinidade entre duas moléculas. Em um ensaio de ligação de filtro , os filtros são usados para capturar as membranas celulares, sugando o meio através delas. Este método rápido ocorre em uma velocidade rápida em que a filtração e uma recuperação podem ser obtidas para a fração encontrada. A lavagem dos filtros com um tampão remove os ligantes não ligados residuais e quaisquer outros ligantes presentes que possam ser removidos dos locais de ligação. Os complexos receptor-ligante presentes enquanto o filtro está sendo lavado não se dissociarão significativamente porque serão completamente capturados pelos filtros. As características do filtro são importantes para cada trabalho que está sendo executado. Um filtro mais espesso é útil para obter uma recuperação mais completa de pequenos pedaços de membrana, mas pode exigir um tempo de lavagem mais longo. Recomenda-se o pré-tratamento dos filtros para ajudar a reter peças de membrana carregadas negativamente. Mergulhar o filtro em uma solução que daria ao filtro uma carga superficial positiva atrairia os fragmentos de membrana carregados negativamente.
Ligação de células em tempo real
Neste tipo de ensaio, a ligação de um ligando às células é seguida ao longo do tempo. O sinal obtido é proporcional ao número de ligantes ligados a uma estrutura alvo, geralmente um receptor, na superfície da célula. As informações sobre a interação ligante-alvo são obtidas a partir da mudança de sinal ao longo do tempo e parâmetros cinéticos, como a constante de taxa de associação k a , a constante de taxa de dissociação k d e a afinidade K D podem ser calculados. Ao medir a interação diretamente nas células, nenhum isolamento da proteína alvo é necessário, o que pode ser desafiador, especialmente para algumas proteínas de membrana. Para garantir que a interação com a estrutura alvo pretendida seja medida, controles biológicos apropriados, como células que não expressam a estrutura alvo, são recomendados.
Medições em tempo real usando abordagens sem rótulo ou baseadas em rótulo têm sido usadas para analisar as interações biomoleculares em células fixadas ou vivas.
A vantagem de medir as interações ligante-receptor em tempo real é que o equilíbrio de ligação não precisa ser alcançado para a determinação precisa da afinidade.
Especificidade de ligação
Os efeitos de uma droga são o resultado de sua seletividade de ligação com propriedades macromoléculas de um organismo, ou a afinidade com a qual diferentes ligantes se ligam a um substrato. Mais especificamente, a especificidade e seletividade de um ligante para seu respectivo receptor fornece aos pesquisadores a oportunidade de isolar e produzir efeitos específicos de drogas por meio da manipulação de concentrações de ligante e densidades de receptor. Hormônios e neurotransmissores são ligantes reguladores endógenos essenciais que afetam os receptores fisiológicos dentro de um organismo. As drogas que agem sobre esses receptores são incrivelmente seletivas para produzir as respostas necessárias das moléculas sinalizadoras.
A ligação específica refere-se à ligação de um ligando a um receptor, e é possível que haja mais de um local de ligação específico para um ligando. A ligação não específica refere-se à ligação de um ligante a algo diferente do seu receptor designado, como vários outros receptores ou diferentes tipos de transportadores na membrana celular. Por exemplo, vários antagonistas podem se ligar a vários tipos de receptores. No caso de antagonistas muscarínicos, eles também podem se ligar a receptores de histamina. Esses padrões de ligação são tecnicamente considerados específicos, pois o destino do ligante é específico para vários receptores. No entanto, os pesquisadores podem não estar focados em tais comportamentos em comparação com outros fatores de ligação. No entanto, o comportamento de ligação inespecífico é uma informação muito importante para adquirir. Essas estimativas são medidas examinando como um ligante se liga a um receptor enquanto reage simultaneamente a um agente substituto (antagonista) que impedirá a ocorrência de ligação específica.
Tipos de ligação específicos para interações de ligante e receptor:
| Efeitos endógenos de imitação | Inibe efeitos endógenos |
|---|---|
| Agonista | Antagonista |
| Agonista Parcial | Antagonistas negativos (ver: agonista inverso ) |
Avanços tecnológicos
As tecnologias para o ensaio de ligação do ligante continuam a avançar em relação ao aumento da velocidade e à manutenção de procedimentos com boa relação custo-benefício, ao mesmo tempo em que mantém e aumenta a precisão e a sensibilidade. Alguns avanços tecnológicos incluem novos reagentes de ligação como alternativas aos anticorpos, soluções alternativas de corantes e sistemas de microplacas, e o desenvolvimento de um método para pular a etapa de filtração, que é necessária em muitos processos de ensaio de ligação de ligante.
Uma molécula de sinalização proeminente nas células é o cálcio , (Ca 2+ ), que pode ser detectado com um corante Fluo-4 acetoximetil. Liga-se aos íons Ca 2+ livres, que por sua vez aumentam ligeiramente a fluorescência do Fluo-4 AM. A desvantagem da formulação do corante Fluo-4 é que uma etapa de lavagem é necessária para remover o corante extracelular, que pode fornecer sinais de fundo indesejados. Por exemplo, a lavagem exerce pressão adicional sobre as células, além de consumir tempo, o que impede uma análise oportuna. Recentemente, uma solução alternativa de corante e sistema de microplaca foi desenvolvido, denominado FLIPR® (leitor de placas de imagem fluorométrica), que usa um reagente de ensaio Cálcio 3 que não requer uma etapa de lavagem. Como resultado, a mudança na fluorescência do corante pode ser vista em tempo real, sem demora, usando um laser excitatório e um dispositivo de carga acoplada .
Muitos ensaios de ligação ao ligante requerem uma etapa de filtração para separar os ligantes ligados e não ligados antes da triagem. Um método chamado Ensaio de proximidade de cintilação (SPA) foi desenvolvido recentemente, o que elimina essa etapa crucial. Ele funciona por meio de grânulos de rede de cristal, que são revestidos com moléculas de acoplamento de ligantes e preenchidos com íons de cério . Eles emitem rajadas de luz quando estimulados por um isótopo, que podem ser facilmente medidos. Os ligandos são radiomarcados usando 3H ou 125I e liberados no ensaio. Uma vez que apenas os radioligandos que se ligam diretamente aos grânulos iniciam um sinal, os ligantes livres não interferem durante o processo de triagem.
Limitações
Por natureza, os ensaios devem ser realizados em um ambiente controlado in vitro, portanto, este método não fornece informações sobre a ligação ao receptor in vivo. Os resultados obtidos podem apenas verificar se um ligante específico se ajusta a um receptor, mas os ensaios não fornecem nenhuma maneira de saber a distribuição dos receptores de ligação ao ligante em um organismo.
A ligação do ligante in vivo e a distribuição do receptor podem ser estudadas usando Tomografia por Emissão de Pósitrons (PET), que funciona por indução de um radionuclídeo em um ligante, que é então liberado no corpo de um organismo estudado. Os ligantes radiomarcados são localizados espacialmente por um scanner PET para revelar áreas no organismo com altas concentrações de receptores.