Princípio de Sabatier - Sabatier principle
O princípio de Sabatier é um conceito qualitativo em catálise química heterogênea que leva o nome do químico francês Paul Sabatier . Ele afirma que as interações entre o catalisador e o substrato devem ser "perfeitas"; isto é, nem muito forte nem muito fraco. Se a interação for muito fraca, a molécula deixará de se ligar ao catalisador e nenhuma reação ocorrerá. Por outro lado, se a interação for muito forte, o produto não se dissocia.
O princípio pode ser mostrado graficamente traçando a taxa de reação em relação a uma propriedade, como o calor de adsorção do reagente pelo catalisador. Essas parcelas passam por um máximo, parecendo mais ou menos com um triângulo ou uma parábola invertida, e são chamadas de parcelas vulcânicas por causa de sua forma. Gráficos tridimensionais análogos também podem ser construídos contra duas propriedades diferentes, como os calores de adsorção dos dois reagentes para uma reação de dois componentes. Nesse caso, o gráfico é geralmente mostrado como um gráfico de contorno e é chamado de superfície de vulcão . Parcelas de vulcões foram introduzidas por Balandin.
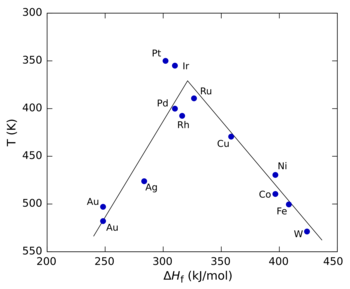
A figura à direita mostra um gráfico de vulcão para a decomposição do ácido fórmico usando diferentes metais de transição como catalisadores. Neste caso, o calor de formação (Δ H f ) do sal formato de metal foi usado para o eixo x porque estudos mostraram que o intermediário da reação era um formato de superfície. Para o eixo y, a temperatura na qual a reação atinge uma taxa específica foi usada (o eixo y é plotado ao contrário para preservar a forma convencional de "vulcão"). Em valores baixos de Δ H f , a reação é lenta (em outras palavras, requer temperaturas mais altas) porque a taxa de adsorção é lenta e limitante da taxa . Em altos valores de Δ H f , a dessorção se torna a etapa limitadora da taxa. A taxa máxima, que é observada para os metais do grupo da platina neste caso, requer valores intermediários de Δ H f , sendo a taxa uma combinação da taxa de adsorção e da taxa de dessorção.