Septin - Septin
| Divisão celular / proteína de ligação a GTP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Cell_Div_GTP_bd | ||||||||
| Pfam | PF00735 | ||||||||
| Clã Pfam | CL0023 | ||||||||
| InterPro | IPR000038 | ||||||||
| |||||||||
Septinas são um grupo de GTP - proteínas de ligação expressas em todas as células eucarióticas excepto plantas . Diferentes septinas formam complexos de proteínas entre si. Esses complexos podem ainda se agrupar em filamentos, anéis e gazes. Montadas como tal, as septinas funcionam nas células localizando outras proteínas , fornecendo um suporte ao qual as proteínas podem se anexar ou formando uma barreira que impede a difusão de moléculas de um compartimento da célula para outro, ou no córtex celular como um barreira à difusão de proteínas ligadas à membrana.
Septinas têm sido implicadas na localização de processos celulares no local da divisão celular e na membrana celular em locais onde estruturas especializadas como cílios ou flagelos estão fixados ao corpo celular. Nas células de levedura, eles compartimentam partes da célula e constroem uma estrutura para fornecer suporte estrutural durante a divisão celular no septo , de onde derivam seu nome. Pesquisas em células humanas sugerem que as septinas constroem gaiolas ao redor de bactérias patogênicas , que as imobilizam e as impedem de invadir outras células.
Como proteínas formadoras de filamentos, as septinas podem ser consideradas parte do citoesqueleto . Além de formar filamentos apolares, as septinas se associam às membranas celulares , ao córtex celular, aos filamentos de actina e aos microtúbulos .
Estrutura
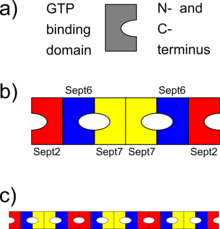
b) esquemático do complexo heterohexamérico de septina (de septinas humanas), onde diferentes septinas se ligam entre si por meio de sua ligação de GTP domínios ou através dos terminais N e C. Observe a simetria do complexo
c) esquemático como os complexos de septina podem se alinhar para formar filamentos de septina
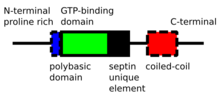
Septinas são proteínas P-Loop -NTPase que variam em peso de 30-65 kDa. Septinas são altamente conservadas entre diferentes espécies eucarióticas. Eles são compostos por um terminal N rico em prolina de comprimento variável com um motivo de ligação de fosfoinositídeo básico importante para a associação de membrana, um domínio de ligação de GTP , um domínio de elemento único de Septina altamente conservado e uma extensão C-terminal incluindo um domínio de bobina enrolada de comprimento variável.
As septinas interagem por meio de seus respectivos domínios de ligação a GTP ou por meio de seus terminais N e C. Organismos diferentes expressam um número diferente de septinas, e a partir desses oligômeros simétricos são formados. Por exemplo, na levedura, o complexo octamérico formado é Cdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11. Em humanos, complexos hexaméricos ou octaméricos são possíveis. Inicialmente, foi indicado que o complexo humano era set7-set6-set2-set2-set6-set7; mas recentemente este pedido foi revisado para Set2-Set6-Set7-Set7-Set6-Set2 (ou Set2-Set6-Set7-Set3-Set3-Sept7-Sept6-Set2 no caso de hetero-oligômeros octaméricos). Esses complexos então se associam para formar filamentos não polares, feixes de filamentos, gaiolas ou estruturas em anel nas células.
Ocorrência
Septinas são encontradas em fungos , animais e algumas algas eucarióticas, mas não são encontradas em plantas.
| Espécies | Grupo ( filogenético ) | Genes septina | |
|---|---|---|---|
| Fungi | Saccharomyces cerevisiae | Cdc3 | Cdc3 |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, Shs1, Spr28 | ||
| Cdc12 | Cdc12, Spr3 | ||
| Schizosaccharomyces pombe | Spn1 | Spn1 | |
| Spn2 | Spn2 | ||
| Spn3 | Spn3, Spn5, Spn7 | ||
| Spn4 | Spn4, Spn6 | ||
| Candida albicans | Cdc3 | Cdc3 | |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, Set7, Spr28 | ||
| Cdc12 | Cdc12, Spr3 | ||
| Aspergillus nidulans | AspD | AspD | |
| AspB | AspB | ||
| Um spa | Um spa | ||
| AspC | AspC | ||
| AspE | AspE | ||
| Animais | Humanos | 2 de setembro | Set1, Spet2, Set4, Set5 |
| 3 de setembro | 3 de setembro, 9 de setembro, 12 de setembro | ||
| 6 de setembro | Set 6, Set 8, Set 10, Set 11, Set 14 | ||
| 7 de setembro | Set 7 (Set 13 como um pseudogene) | ||
| Caenorhabditis elegans | UNC-59 | UNC-59 | |
| UNC-61 | UNC-61 |
Em fermento
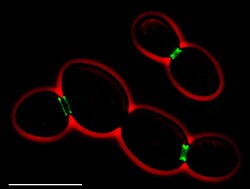
• Verde: septinas ( AgSEP7- GFP )
• Vermelho: contorno celular ( contraste de fase )
• Barra de escala: 10 μm
Existem sete septinas diferentes em Saccharomyces cerevisiae . Cinco deles estão envolvidos na mitose, enquanto dois (Spr3 e Spr28) são específicos para esporulação . As septinas mitóticas (Cdc3, Cdc10, Cdc11, Cdc12, Shs1) formam uma estrutura em anel no pescoço do botão durante a divisão celular . Eles estão envolvidos na seleção do local do botão, no posicionamento do fuso mitótico , no crescimento polarizado e na citocinese . As septinas esporuladas (Spr3, Spr28) localizam-se junto com Cdc3 e Cdc11 nas bordas das membranas prosporos.
Organização
As septinas formam uma região especializada no córtex celular conhecida como córtex das septinas. O córtex da septina sofre várias mudanças ao longo do ciclo celular : A primeira estrutura visível da septina é um anel distinto que aparece cerca de 15 minutos antes da emergência do botão . Após a emergência do botão , o anel se alarga para assumir a forma de uma ampulheta ao redor do pescoço do botão-mãe. Durante a citocinese , o córtex da septina se divide em um anel duplo que eventualmente desaparece. Como pode o córtex da septina sofrer mudanças tão dramáticas, embora algumas de suas funções possam exigir que seja uma estrutura estável? A análise FRAP revelou que a renovação das septinas no pescoço sofre várias alterações durante o ciclo celular . A conformação funcional predominante é caracterizada por uma baixa taxa de renovação (estado congelado), durante a qual as septinas são fosforiladas . As mudanças estruturais requerem uma desestabilização do córtex da septina (estado fluido) induzida pela desfosforilação antes da emergência do botão , divisão do anel e separação celular .
A composição do córtex da septina não varia apenas ao longo do ciclo celular, mas também ao longo do eixo do botão-mãe. Esta polaridade da rede de septinas permite a concentração de algumas proteínas principalmente no lado materno do pescoço, algumas no centro e outras no local do botão .
Funções
Andaime
As septinas atuam como uma estrutura, recrutando muitas proteínas . Esses complexos de proteínas estão envolvidos na citocinese , deposição de quitina , polaridade celular , formação de esporos , no checkpoint de morfogênese , checkpoint de alinhamento do fuso e seleção do local do botão.
Citocinese
A citocinese da levedura de brotamento é conduzida por dois processos redundantes dependentes da septina: recrutamento e contração do anel da actomiosina e formação do septo por fusão da vesícula com a membrana plasmática . Em contraste com os mutantes da septina , a interrupção de uma única via leva apenas a um retardo na citocinese , não à falha completa da divisão celular . Portanto, prevê-se que as septinas atuem no nível mais a montante da citocinese .
Polaridade celular
Após a troca isotrópica - apical na levedura em brotamento , os componentes corticais , supostamente do exocisto e do polarissoma , são deslocalizados do pólo apical para toda a membrana plasmática do botão, mas não para a célula-mãe. O anel de septina no pescoço serve como uma barreira cortical que impede a difusão da membrana desses fatores entre os dois compartimentos. Essa distribuição assimétrica é abolida nos mutantes da septina .
Alguns mutantes de septina condicionais não formam botões em sua localização axial normal. Além disso, a localização típica de alguns fatores de seleção do local do botão em um anel duplo no pescoço é perdida ou perturbada nesses mutantes . Isso indica que as septinas podem servir como local de ancoragem para tais fatores em células de brotamento axial .
Em fungos filamentosos
Desde sua descoberta em S. cerevisiae , homólogos de septina foram encontrados em outras espécies eucarióticas , incluindo fungos filamentosos . Septinas em fungos filamentosos exibem uma variedade de formas diferentes dentro de células individuais , onde controlam aspectos da morfologia filamentosa .
Candida albicans
O genoma de C. albicans codifica homólogos de todas as septinas de S. cerevisiae . Sem os genes Cdc3 e Cdc12, Candida albicans não pode proliferar, outras septinas afetam a morfologia e a deposição de quitina , mas não são essenciais. Candida albicans pode apresentar diferentes morfologias de crescimento vegetativo, o que determina o aparecimento de estruturas septinas. As hifas recém-formadas formam um anel de septina na base, os anéis duplos se formam nos locais de septação das hifas e uma capa de septina se forma nas pontas das hifas. Filamentos de septina alongados circundam os clamidósporos esféricos . Anéis duplos de septinas no local da septação também apresentam polaridade de crescimento, com o anel da ponta crescente se desmontando, enquanto o anel basal permanece intacto.
Aspergillus nidulans
Cinco septinas são encontradas em A. nidulans (AnAspAp, AnAspBp, AnAspCp, AnAspDp, AnAspEp). AnAspBp forma anéis únicos nos locais de septação que eventualmente se dividem em anéis duplos. Além disso, o AnAspBp forma um anel nos locais de emergência do ramo, que se alarga em uma faixa conforme o ramo cresce. Como em C. albicans , os anéis duplos refletem a polaridade da hifa . No caso de Aspergillus nidulans, a polaridade é transmitida pela desmontagem do anel mais basal (o anel mais afastado da ponta de crescimento das hifas), deixando o anel apical intacto, potencialmente como uma pista de orientação de crescimento.
Ashbya Gossypii

• Vermelho: contorno celular ( contraste de fase )
• Inlay: reconstrução 3D de um anel de septina descontínuo
• Barras de escala: 10 μm
O ascomiceto A. gossypii possui homólogos a todas as septinas de S. cerevisiae , sendo um deles duplicado ( AgCDC3, AgCDC10, AgCDC11A, AgCDC11B, AgCDC12, AgSEP7 ). In vivo Estudos de AgSep7p- GFP revelaram que septinas montar em descontínuos hifas anéis perto de crescimento dicas e locais de formação de ramificação, e em assimétricos estruturas na base de pontos de ramificação. Os anéis são feitos de filamentos longos e difusos perto das pontas em crescimento e curtos e compactos mais longe da ponta. Durante a formação do septo , o anel de septina se divide em dois para formar um anel duplo. Os mutantes de deleção Agcdc3Δ, Agcdc10Δ e Agcdc12Δ exibem morfologia aberrante e são defeituosos para a formação de anel de actina , formação de anel de quitina e esporulação . Devido à falta de septos , os mutantes de deleção de septina são altamente sensíveis e o dano de uma única hifa pode resultar na lise completa de um micélio jovem .
Em animais
Em contraste com as septinas na levedura e em contraste com outros componentes do citoesqueleto de animais, as septinas não formam uma rede contínua nas células, mas várias outras dispersas no citoplasma do córtex celular . Estes são integrados a feixes de actina e microtúbulos . Por exemplo, a anilina da proteína de empacotamento de actina é necessária para o controle espacial correto da organização da septina. Nas células espermáticas dos mamíferos , as septinas formam um anel estável denominado anel na cauda. Em camundongos (e potencialmente em humanos também), a formação do anel defeituoso leva à infertilidade masculina.
Humano
Em humanos, as septinas estão envolvidas na citocinese , formação de cílios e neurogênese por meio da capacidade de recrutar outras proteínas ou servir como barreira de difusão. Existem 13 genes humanos diferentes codificando para septinas. As proteínas septinas produzidas por esses genes são agrupadas em quatro subfamílias, cada uma com o nome de seu membro fundador: (i) SEPT2 ( SEPT1 , SEPT4 , SEPT5 ), (ii) SEPT3 ( SEPT9 , SEPT12 ), (iii) SEPT6 ( SEPT8 , SEPT10 , SEPT11 , SEPT14 ) e (iv) SEPT7 . Os complexos de proteínas da septina são montados para formar hetero- hexâmeros (incorporando monômeros selecionados de três grupos diferentes e o monômero de cada grupo está presente em duas cópias; 3 x 2 = 6) ou hetero- octâmeros (monômeros de quatro grupos diferentes, cada monômero presente em duas cópias; 4 x 2 = 8). Esses hetero-oligômeros, por sua vez, formam estruturas de ordem superior, como filamentos e anéis.
Septinas formam estruturas semelhantes a gaiolas em torno de patógenos bacterianos , imobilizando micróbios nocivos e impedindo-os de invadir células saudáveis. Este sistema de defesa celular poderia ser potencialmente explorado para criar terapias para disenteria e outras doenças . Por exemplo, Shigella é uma bactéria que causa diarreia letal em humanos. Para propagar a partir de uma célula para outra, Shigella bactérias desenvolver actina - polímero 'caudas', que impulsionam os micróbios e lhes permitem ganhar entrada em células hospedeiras vizinhos. Como parte da resposta imune, as células humanas produzem uma proteína de sinalização celular chamada TNF-α, que ativa feixes grossos de filamentos de septina para envolver os micróbios dentro da célula hospedeira infectada. Os micróbios que ficam presos nessas gaiolas de septina são decompostos por autofagia . Perturbações nas septinas e mutações nos genes que as codificam podem estar envolvidas na leucemia , câncer de cólon e doenças neurodegenerativas como a doença de Parkinson e a doença de Alzheimer . Terapias potenciais para eles, bem como para doenças bacterianas como a disenteria causada por Shigella , podem fortalecer o sistema imunológico do corpo com drogas que imitam o comportamento do TNF-α e permitem que as gaiolas de septina se proliferem.
Caenorhabditis elegans
No verme nematóide Caenorhabditis elegans, existem dois genes que codificam septinas, e os complexos de septinas contêm as duas septinas diferentes em um complexo tetramérico UNC59-UNC61-UNC61-UNC59. Septinas em C.elegans concentrado no sulco de clivagem e a meio do corpo do fuso , durante a divisão celular . Septinas também estão envolvidas na migração celular e orientação do axônio em C.elegans .
Nas mitocôndrias
A septina localizada na mitocôndria é chamada de septina mitocondrial (M-septina). Foi identificada como uma proteína que interage com CRMP / CRAM no cérebro de rato em desenvolvimento.
História
As septinas foram descobertas em 1970 por Leland H. Hartwell e colegas em uma triagem de mutantes sensíveis à temperatura que afetam a divisão celular (mutantes cdc) em leveduras ( Saccharomyces cerevisiae ). A triagem revelou quatro mutantes que impediram a citocinese em temperatura restritiva. Os genes correspondentes representam as quatro septinas originais, ScCDC3, ScCDC10, ScCDC11 e ScCDC12 . Apesar da citocinese interrompida, as células continuaram brotando , síntese de DNA e divisão nuclear , o que resultou em grandes células multinucleadas com vários botões alongados. Em 1976, a análise de micrografias eletrônicas revelou ~ 20 estriações uniformemente espaçadas de filamentos de 10 nm ao redor do pescoço do botão-mãe em células do tipo selvagem, mas não em células mutantes de septina. Estudos de imunofluorescência revelaram que as proteínas septinas colocalizam em um anel de septina no pescoço. A localização de todas as quatro septinas é interrompida nos mutantes Sccdc3 e Sccdc12 condicionais , indicando a interdependência das proteínas septinas. Um forte apoio para esta descoberta foi fornecido por estudos bioquímicos : As quatro septinas originais co-purificadas em colunas de afinidade , junto com uma quinta proteína septina, codificada por ScSEP7 ou ScSHS1 . Septinas purificadas de leveduras em brotamento, Drosophila , Xenopus e células de mamíferos são capazes de se autoassociar in vitro para formar filamentos. Como as septinas interagem in vitro para formar hetero-oligômeros que se agrupam em filamentos foi estudado em detalhes em S. cerevisiae .
Micrografias de filamentos purificados levantaram a possibilidade de que as septinas sejam organizadas em paralelo ao eixo do botão-mãe. As estrias de 10 nm vistas em micrografias eletrônicas podem ser o resultado da interação lateral entre os filamentos. As cepas mutantes sem fatores importantes para a organização da septina apóiam essa visão. Em vez de anéis contínuos, as septinas formam barras orientadas ao longo do eixo do botão-mãe em mutantes de deleção de ScGIN4, ScNAP1 e ScCLA4 .
Referências
Leitura adicional
- Longtine MS, DeMarini DJ, Valencik ML, Al-Awar OS, Fares H, De Virgilio C, Pringle JR (fevereiro de 1996). "As septinas: papéis na citocinese e outros processos". Curr. Opiniões Cell Biol . 8 (1): 106–19. doi : 10.1016 / S0955-0674 (96) 80054-8 . PMID 8791410 .
- Faty M, Fink M, Barral Y (junho de 2002). "Septinas: um anel para separar mãe e filha". Curr. Genet . 41 (3): 123–31. doi : 10.1007 / s00294-002-0304-0 . PMID 12111093 . S2CID 22744214 .
- Versele M, Gullbrand B, Shulewitz MJ, Cid VJ, Bahmanyar S, Chen RE, Barth P, Alber T, Thorner J (outubro de 2004). "Interações proteína-proteína que governam a montagem do heteropentâmero de septina e a organização do filamento de septina em Saccharomyces cerevisiae" . Mol. Biol. Cell . 15 (10): 4568–83. doi : 10.1091 / mbc.E04-04-0330 . PMC 519150 . PMID 15282341 .
- Douglas LM, Alvarez FJ, McCreary C, Konopka JB (setembro de 2005). "Função da septina em sistemas modelo de levedura e fungos patogênicos" . Célula Eucariótica . 4 (9): 1503–12. doi : 10.1128 / EC.4.9.1503-1512.2005 . PMC 1214204 . PMID 16151244 .
- Gladfelter AS (março de 2006). Controle da forma das células fúngicas filamentosas por septinas e forminhas ". Nat. Rev. Microbiol . 4 (3): 223–9. doi : 10.1038 / nrmicro1345 . PMID 16429163 . S2CID 40080522 .
- Hall PA; Russell SEH; Pringle JR (2008). As septinas . Oxford: John Wiley-Blackwell. p. 370. ISBN 978-0-470-51969-1.
- Gonzalez-Novo A; Vázquez de Aldana CR; Jimenez J (2009). "Septinas fúngicas: um anel para governar tudo?" . Cent. EUR. J. Biol . 4 (3): 274–289. doi : 10.2478 / s11535-009-0032-2 .