Tetrafluoroborato de trimetiloxônio - Trimethyloxonium tetrafluoroborate
|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Tetrafluoroborato de trimetiloxônio
|
|
| Outros nomes
Sal de Meerwein de fluoroborato de trimetiloxônio |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100,006,360 |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 3 H 9 B F 4 O | |
| Massa molar | 147,91 g · mol −1 |
| Ponto de fusão | 179,6-180 ° C (355,3-356,0 ° F; 452,8-453,1 K) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
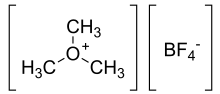
O tetrafluoroborato de trimetiloxônio é o composto orgânico com a fórmula (CH
3 )
3 OBF
4 . (Às vezes é chamado de "sal de Meerwein" em homenagem a Hans Meerwein .) Este sal é um forte agente de metilação , sendo um equivalente sintético de CH +
3 . É um sólido branco que se degrada rapidamente com a exposição à umidade atmosférica, embora seja robusto o suficiente para ser pesado e dispensado rapidamente sem o benefício da proteção da atmosfera inerte. O tetrafluoroborato de trietiloxônio é um reagente intimamente relacionado.
Preparação e reações
O composto é preparado pela reação de trifluoreto de boro com éter dimetílico e epicloridrina :
- 4 mim
2 O · BF
3 + 2 mim
2 O + 3 C
2 H
3 (O) CH
2 Cl → 3 Me
3 O + BF -
4 + B [(OCH (CH
2 Cl) CH
2 OMe]
3
O sal hidrolisa prontamente:
-
Eu
3 OBF
4 + H
2 O → eu
2 O + MeOH + HBF
4
O tetrafluoroborato de trimetiloxônio é geralmente classificado como o reagente comercialmente disponível mais forte para metilação eletrofílica , sendo mais forte do que ésteres de sulfonato de metila, incluindo triflato de metila e fluorossulfonato de metila ("metil mágico"). Apenas os reagentes de dimetilhalônio exóticos ( Me
2 X + SbF -
6 , X = Cl, Br, I), metilo carboranate reagentes, e a transitoriamente gerado methyldiazonium catiónica ( MeN +
2 ) são fontes mais fortes de metila eletrofílica.
Devido à sua alta reatividade, é rapidamente destruído pela umidade atmosférica e é melhor armazenado em uma caixa de luvas de atmosfera inerte a -20 ° C. Seus produtos de degradação são corrosivos, embora seja consideravelmente menos perigoso do que o triflato de metila ou o fluorossulfonato de metila, devido à sua falta de volatilidade.
