Catechin - Catechin

|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
(2 R , 3 S ) -2- (3,4-Dihidroxifenil) -3,4-dihidro- 2H -cromeno-3,5,7-triol
|
|
| Outros nomes
Cianidanol
Cianidanol (+) - catequina D-Catequina Ácido catecínico Ácido catequínico Cianidol Dexcianidanol (2 R , 3 S ) -Catequina 2,3- trans- Catequina (2 R , 3 S ) -Flavan-3,3 ′, 4 ′, 5,7-pentol |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 3DMet | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100,005,297 |
| Número EC | |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 15 H 14 O 6 | |
| Massa molar | 290,271 g · mol −1 |
| Aparência | Sólido incolor |
| Ponto de fusão | 175 a 177 ° C (347 a 351 ° F; 448 a 450 K) |
| UV-vis (λ max ) | 276 nm |
|
Rotação quiral ([α] D )
|
+ 14,0 ° |
| Perigos | |
| Riscos principais | Mutagênico para células somáticas de mamíferos, mutagênico para bactérias e leveduras |
| Ficha de dados de segurança | sciencelab AppliChem |
| Pictogramas GHS |

|
| Palavra-sinal GHS | Aviso |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
(+) - catequina: 10.000 mg / kg em rato (RTECS) 10.000 mg / kg em camundongo 3.890 mg / kg em rato (outra fonte) |
| Farmacologia | |
| Oral | |
| Farmacocinética : | |
| Urinas | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Catequina / k ul t ɪ tʃ ɪ n / é um flavan-3-ol , um tipo de fenol natural e antioxidante . É um metabólito secundário da planta . Pertence ao grupo dos flavan-3-ols (ou simplesmente flavonóis), parte da família química dos flavonóides .
O nome da família química da catequina deriva de catechu , que é o suco tânico ou extrato fervido de Mimosa catechu ( Acacia catechu Lf).
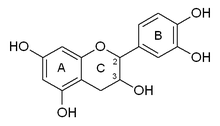
Química
A catequina possui dois anéis de benzeno (chamados de anéis A e B) e um heterociclo dihidropirano (o anel C) com um grupo hidroxila no carbono 3. O anel A é semelhante a uma porção de resorcinol, enquanto o anel B é semelhante a um porção catecol . Existem dois centros quirais na molécula dos carbonos 2 e 3. Portanto, ela tem quatro diastereoisômeros . Dois dos isômeros estão na configuração trans e são chamados de catequina e os outros dois estão na configuração cis e são chamados de epicatequina .
O isômero de catequina mais comum é o (+) - catequina. O outro estereoisômero é (-) - catequina ou ent- catecina. O isômero de epicatequina mais comum é (-) - epicatequina (também conhecido pelos nomes L-epicatequina, epicatequina, (-) - epicatequina, l-acacatequina, l-epicatequina, epicatequina, 2,3-cis-epicatequina ou ( 2 R , 3 R ) - (-) - epicatequina).
Os diferentes epímeros podem ser distinguidos usando cromatografia em coluna quiral .
Não fazendo referência a nenhum isômero específico, a molécula pode ser chamada apenas de catequina. As misturas dos diferentes enantiômeros podem ser chamadas de (+/-) - catequina ou DL-catequina e (+/-) - epicatequina ou DL-epicatequina.
A catequina e a epicatequina são os blocos de construção das proantocianidinas , um tipo de tanino condensado.
- Galeria Diastereoisomers
Além disso, a flexibilidade do C-ring permite dois isômeros de conformação , colocando o anel B em uma posição pseudoequatorial (conformador E) ou em uma posição pseudoaxial (conformador A). Estudos confirmaram que (+) - catequina adota uma mistura de conformadores A e E em solução aquosa e seu equilíbrio conformacional foi avaliado como 33:67.
Como flavonóides, as catequinas podem atuar como antioxidantes quando em alta concentração in vitro , mas em comparação com outros flavonóides, seu potencial antioxidante é baixo. A capacidade de extinguir o oxigênio singlete parece estar relacionada à estrutura química da catequina, com a presença da fração catecol no anel B e a presença de um grupo hidroxila ativando a ligação dupla no anel C.
Oxidação
Experimentos eletroquímicos mostram que o mecanismo de oxidação da (+) - catequina ocorre em etapas sequenciais, relacionadas com os grupos catecol e resorcinol e que a oxidação é dependente do pH. A oxidação dos grupos doadores de elétrons do catecol 3 ', 4'-diidroxila ocorre primeiro, em potenciais positivos muito baixos, e é uma reação reversível. Os grupos hidroxila da porção resorcinol oxidados posteriormente mostraram sofrer uma reação de oxidação irreversível.
O sistema lacase / ABTS oxida (+) - catequina em produtos oligoméricos dos quais a proantocianidina A2 é um dímero.
Dados espectrais
| UV-Vis | |
|---|---|
| Lambda-max : | 276 nm |
| Coeficiente de extinção (log ε) | 4,01 |
| IR | |
| Principais bandas de absorção | 1600 cm -1 (anéis de benzeno) |
| NMR | |
|
Proton NMR
|
δ : 2,49 (1H, dd, J = 16,0, 8,6 Hz, H-4a), |
| Carbon-13 NMR | |
| Outros dados de NMR | |
| em | |
| Massas de fragmentos principais |
ESI-MS [M + H] + m / z: 291,0
|
Ocorrências naturais
(+) - Catequina e (-) - epicatequina, bem como seus conjugados de ácido gálico, são constituintes onipresentes de plantas vasculares e componentes frequentes de remédios fitoterápicos tradicionais , como Uncaria rhynchophylla . Os dois isômeros são encontrados principalmente como constituintes do cacau e do chá , bem como nas uvas Vitis vinifera .
Na comida
As principais fontes alimentares de catequinas na Europa e nos Estados Unidos são o chá e as frutas em pomó .
As catequinas e epicatequinas são encontradas no cacau , que, segundo uma base de dados, apresenta o maior teor (108 mg / 100 g) de catequinas entre os alimentos analisados, seguido do suco de ameixa (25 mg / 100 ml) e da vagem de fava (16 mg /100g). O óleo de açaí , obtido do fruto do açaí ( Euterpe oleracea ), contém (+) - catequinas (67 mg / kg).
As catequinas são diversas entre os alimentos, de pêssegos a chá verde e vinagre . As catequinas são encontradas nos grãos de cevada, onde são o principal composto fenólico responsável pela descoloração da massa . O sabor associado à (+) - catequina ou (-) - epicatequina monomérica é descrito como levemente adstringente , mas não amargo.
Metabolismo
Biossíntese
A biossíntese da catequina começa com a unidade inicial ma 4-hidroxicinamoil CoA que sofre extensão da cadeia pela adição de três malonil-CoAs através de uma via PKSIII. O 4-hidroxicinamoil CoA é biossintetizado a partir da L-fenilalanina através da via do Shikimato. A L-fenilalanina é primeiro desaminada pela fenilalanina amônia liase (PAL) formando ácido cinâmico que é então oxidado a ácido 4-hidroxicinâmico pela cinamato 4-hidroxilase. A chalcona sintase catalisa a condensação de 4-hidroxicinamoil CoA e três moléculas de malonil-CoA para formar a chalcona . A chalcona é então isomerizada em naringenina pela chalcona isomerase, que é oxidada a eriodictiol pela flavonóide 3'-hidroxilase e posteriormente oxidada à taxifolina pela flavanona 3-hidroxilase. A taxifolina é então reduzida pela dihidroflavanol 4-redutase e leucoantocianidina redutase para produzir catequina. A biossíntese da catequina é mostrada abaixo
A leucocianidina redutase (LCR) usa 2,3-trans-3,4-cis- leucocianidina para produzir (+) - catequina e é a primeira enzima na via específica das proantocianidinas (PA). Sua atividade foi medida em folhas, flores e sementes das leguminosas Medicago sativa , Lotus japonicus , Lotus uliginosus , Hedysarum sulfurescens e Robinia pseudoacacia . A enzima também está presente na Vitis vinifera (uva).
Biodegradação
A catequina oxigenase, uma enzima chave na degradação da catequina, está presente em fungos e bactérias.
Entre as bactérias, a degradação de (+) - catequina pode ser alcançada por Acinetobacter calcoaceticus . A catequina é metabolizada em ácido protocatecuico (PCA) e ácido carboxílico floroglucinol (PGCA). Também é degradado por Bradyrhizobium japonicum . O ácido fluoroglucinol carboxílico é posteriormente descarboxilado em floroglucinol , que é desidroxilado em resorcinol . O resorcinol é hidroxilado em hidroxiquinol . O ácido protocatecuico e o hidroxiquinol sofrem clivagem intradiol através do protocatecuato 3,4-dioxigenase e hidroxiquinol 1,2-dioxigenase para formar β-carboxi cis, ácido cis-mucônico e acetato de maleila .
Entre os fungos, a degradação da catequina pode ser alcançada por Chaetomium cupreum .
Metabolismo em humanos

As catequinas são metabolizadas após a absorção no trato gastrointestinal , em particular no jejuno , e no fígado , resultando nos chamados metabólitos de epicatequina estruturalmente relacionados (SREM). As principais vias metabólicas para SREMs são glucuronidação , sulfatação e metilação do catecol grupo por transferase de catecol-O-metil , com apenas pequenas quantidades detectado no plasma. A maioria das catequinas dietéticas são, entretanto, metabolizadas pelo microbioma colônico em gama-valerolactonas e ácidos hipúricos que sofrem biotransformação , glucuronidação , sulfatação e metilação no fígado .
A configuração estereoquímica das catequinas tem um forte impacto na sua absorção e metabolismo, uma vez que a absorção é maior para (-) - epicatequina e menor para (-) - catequina.
Biotransformação
A biotransformação de (+) - catequina em taxifolina por uma oxidação em duas etapas pode ser alcançada por Burkholderia sp.
(+) - Catequina e (-) - epicatequina são transformadas pelo fungo filamentoso endofítico Diaporthe sp. nos derivados de 3,4-cis-dihidroxiflavana, (+) - (2R, 3S, 4S) -3,4,5,7,3 ', 4'-hexa-hidroxiflavana (leucocianidina) e (-) - (2R, 3R , 4R) -3,4,5,7,3 ', 4'-hexahidroxiflavana , respectivamente, enquanto (-) - catequina e (+) - epicatequina com um grupo 2S-fenil resistiu à biooxidação.
Leucoanthocyanidin redutase (LAR) usos (2 R , 3 S ) -catechin, NADP + e H 2 O para produzir 2,3-trans-3,4-cis leucocianidina , NADPH e H + . Sua expressão gênica foi estudada no desenvolvimento de bagas e folhas de videira.
Glicosídeos
- (2R, 3S) -Catechin-7-O-β-D-glucopiranosídeo pode ser isolado de cevada ( Hordeum vulgare L.) e malte.
- O epigeosídeo (catequina-3-O-alfa-L-ramnopiranosil- (1-4) -beta-D-glucopiranosil- (1-6) -beta-D-glucopiranosídeo) pode ser isolado dos rizomas de Epigynum auritum .
Pesquisar
Função vascular
Apenas evidências limitadas de estudos dietéticos indicam que as catequinas podem afetar a vasodilatação dependente do endotélio, o que pode contribuir para a regulação normal do fluxo sanguíneo em humanos. As catequinas do chá verde podem melhorar a pressão arterial, especialmente quando a pressão arterial sistólica está acima de 130 mmHg.
Devido ao extenso metabolismo durante a digestão, o destino e a atividade dos metabólitos da catequina responsáveis por esse efeito nos vasos sanguíneos, bem como o modo real de ação, são desconhecidos.
A Autoridade Europeia para a Segurança dos Alimentos estabeleceu que os flavonóides do cacau têm um efeito na função vascular em adultos saudáveis, concluindo: "Os flavonóis do cacau ajudam a manter a vasodilatação dependente do endotélio, o que contribui para o fluxo sanguíneo normal". Para que tal efeito ocorra, o consumo diário de 200 mg de flavonóides de cacau, possivelmente de 2,5 g de cacau em pó com alto teor de flavanol ou 10 g de chocolate preto com alto teor de flavanol, deve ocorrer em uma dieta balanceada.
Outros dados de estudos de coorte observacionais não mostraram uma associação consistente entre a ingestão de flavan-3-ol e o risco de doenças cardiovasculares. Uma meta-análise também indicou que as catequinas do chá verde podem afetar favoravelmente o colesterol .
De outros
Uma meta-análise limitada mostrou que aumentar o consumo de chá verde e suas catequinas para sete xícaras por dia proporcionou uma pequena redução no câncer de próstata . Métodos de nanopartículas estão sob pesquisa preliminar como sistemas de entrega potencial de catequinas.
Efeitos botânicos
As catequinas liberadas no solo por algumas plantas podem impedir o crescimento de suas vizinhas, uma forma de alelopatia . Centaurea maculosa , a knapweed-pintada frequentemente estudada para este comportamento, libera isômeros de catequina no solo através de suas raízes, potencialmente tendo efeitos como um antibiótico ou herbicida . Uma hipótese é que ele faz com que uma onda de espécies reativas de oxigênio através da raiz da planta alvo mate as células da raiz por apoptose . A maioria das plantas no ecossistema europeu tem defesas contra a catequina, mas poucas plantas estão protegidas contra ela no ecossistema da América do Norte, onde Centaurea maculosa é uma erva daninha invasora e descontrolada.
A catequina atua como um fator inibidor de infecção em folhas de morango. A epicatequina e a catequina podem prevenir a doença do café, inibindo a melanização apressorial de Colletotrichum kahawae .
Referências
links externos
-
 Mídia relacionada a (+) - Catechin no Wikimedia Commons
Mídia relacionada a (+) - Catechin no Wikimedia Commons