Compostos de chumbo - Lead compounds
Os compostos de chumbo existem com o chumbo em dois estados de oxidação principais: +2 e +4. O primeiro é mais comum. Os compostos inorgânicos de chumbo (IV) são tipicamente oxidantes fortes ou existem apenas em soluções altamente ácidas.
Química
Várias formas oxidadas de chumbo são facilmente reduzidas ao metal. Um exemplo é o aquecimento do PbO com agentes redutores orgânicos suaves, como a glicose. A mistura do óxido e do sulfeto aquecidos juntos também formará o metal.
- 2 PbO + PbS → 3 Pb + SO 2
O chumbo metálico é atacado (oxidado) apenas superficialmente pelo ar, formando uma fina camada de óxido de chumbo que o protege de oxidação posterior. O metal não é atacado por ácidos sulfúrico ou clorídrico . Ele se dissolve em ácido nítrico com a evolução do gás óxido nítrico para formar Pb (NO 3 ) 2 dissolvido .
- 3 Pb + 8 H + + 8 NO -
3 → 3 Pb 2+ + 6 NO -
3 2 + NO + 4 H 2 O
Quando aquecido com nitratos de metais alcalinos, o chumbo metálico oxida para formar PbO (também conhecido como litharge ), deixando o nitrito alcalino correspondente . O PbO é representativo do estado de oxidação +2 do chumbo. É solúvel em ácidos nítrico e acético , de cujas soluções é possível precipitar haleto , sulfato , cromato , carbonato (PbCO 3 ) e carbonato básico ( Pb
3 (OH)
2 (CO
3 )
2 ) sais de chumbo. O sulfeto também pode ser precipitado a partir de soluções de acetato . Todos esses sais são pouco solúveis em água. Entre os halogenetos, o iodeto é menos solúvel que o brometo, que, por sua vez, é menos solúvel que o cloreto.
O óxido de chumbo (II) também é solúvel em soluções de hidróxido alcalino para formar o sal de plumbite correspondente .
- PbO + 2 OH - + H 2 O → Pb (OH) 2−
4
A cloração das soluções de plumbite causa a formação do estado de oxidação +4 do chumbo.
-
Pb (OH) 2−
4 + Cl 2 → PbO 2 + 2 Cl - + 2 H 2 O
O dióxido de chumbo é representativo do estado de oxidação +4 e é um poderoso agente oxidante . O cloreto neste estado de oxidação é formado apenas com dificuldade e se decompõe prontamente em cloreto de chumbo (II) e cloro gasoso. Não se conhece a existência de brometo e iodeto de chumbo (IV). O dióxido de chumbo dissolve-se em soluções de hidróxido alcalino para formar os condutores correspondentes .
- PbO 2 + 2 OH - + 2 H 2 O → Pb (OH) 2−
6
O chumbo também tem um óxido com estados de oxidação mistos +2 e +4, chumbo vermelho ( Pb
3 O
4 ), também conhecido como minium .
O chumbo forma prontamente uma liga equimolar com sódio metálico que reage com halogenetos de alquila para formar compostos organometálicos de chumbo, como tetraetila chumbo .
Óxidos e sulfeto
Existem três óxidos conhecidos: PbO , Pb 3 O 4 (às vezes chamado de "mínimo") e PbO 2 . O primeiro possui dois alótropos: α-PbO e β-PbO, ambos com estrutura em camadas e chumbo tetracoordenado. O alótropo alfa é vermelho e tem a distância Pb-O de 230 pm; o beta alótropo é amarelo e tem a distância Pb-O de 221 e 249 pm (devido à assimetria). Graças à semelhança, ambos os alótropos podem existir sob condições padrão (beta com pequenas ( 10-5 relativas) impurezas, como Si, Ge, Mo, etc.). O PbO reage com ácidos para formar sais e com álcalis para dar plumbites, [Pb (OH) 3 ] - ou [Pb (OH) 4 ] 2− .
O dióxido pode ser preparado, por exemplo, por halogenização de sais de chumbo (II). O alótropo alfa é romboédrico e o alótropo beta é tetragonal . Ambos os alótropos são de cor preta-marrom e sempre contêm um pouco de água, que não pode ser removida, pois o aquecimento também causa decomposição (em PbO e Pb 3 O 4 ). O dióxido é um poderoso oxidante: pode oxidar os ácidos clorídrico e sulfúrico. Ele não reage com solução alcalina, mas reage com álcalis sólidos para dar hidroxiplumbatos, ou com óxidos básicos para fornecer plumbatos.
A reação do chumbo com enxofre ou sulfeto de hidrogênio produz sulfeto de chumbo. O sólido tem uma estrutura semelhante ao NaCl (cúbica simples), que mantém até o ponto de fusão, 1114 ° C (2037 ° F). Se o aquecimento ocorrer na presença de ar, os compostos se decompõem para dar o monóxido e o sulfato. Os compostos são quase insolúveis em água, ácidos fracos e a solução de (NH 4 ) 2 S / (NH 4 ) 2 S 2 é a chave para a separação do chumbo dos elementos analíticos dos grupos I a III, estanho, arsênio e antimônio. Os compostos se dissolvem em ácidos nítrico e clorídrico, para dar enxofre elementar e sulfeto de hidrogênio, respectivamente. O aquecimento das misturas do monóxido e do sulfeto forma o metal.
- 2 PbO + PbS → 3 Pb + SO 2 ↑
Haletos e outros sais
Aquecer o carbonato de chumbo com fluoreto de hidrogênio produz o hidrofluoreto, que se decompõe no difluoreto quando derrete. Este pó cristalino branco é mais solúvel do que o diiodeto, mas menos do que o dibrometo e o dicloreto. Não existem fluoretos de chumbo coordenados (exceto o cátion instável PbF + ). O tetrafluoreto, um pó cristalino amarelo, é instável.
Outros dihalogenetos são recebidos aquando do aquecimento de sais de chumbo (II) com os halogenetos de outros metais; Os dihaletos de chumbo precipitam para dar cristais ortorrômbicos brancos (o diiodeto forma cristais hexagonais amarelos). Eles também podem ser obtidos por reação direta de elementos em temperaturas que excedem os pontos de fusão de dihalides. Sua solubilidade aumenta com a temperatura; adicionar mais haletos primeiro diminui a solubilidade, mas depois aumenta devido à complexação , com o número de coordenação máximo sendo 6. A complexação depende dos números de íons de haleto, número atômico do metal alcalino, o haleto do qual é adicionado, temperatura e força iônica da solução . O tetracloreto é obtido por dissolução do dióxido em ácido clorídrico; para evitar a decomposição exotérmica, é mantido sob ácido sulfúrico concentrado. O tetrabrometo pode não, e o tetraiodeto definitivamente não existe. A diastatida também foi preparada.
O metal não é atacado por ácidos sulfúrico ou clorídrico . Ele se dissolve em ácido nítrico com a evolução do gás óxido nítrico para formar Pb (NO 3 ) 2 dissolvido . É um sólido bem solúvel em água; é, portanto, a chave para receber os precipitados de haleto , sulfato , cromato , carbonato e carbonato básico Pb 3 (OH) 2 (CO 3 ) 2 sais de chumbo.
Complexos de cloreto
O chumbo (II) forma uma série de complexos com o cloreto , cuja formação altera a química de corrosão do chumbo. Isso tende a limitar a solubilidade do chumbo em meio salino .
| Pb 2+ + Cl - → PbCl + | K 1 = 12,59 |
| PbCl + + Cl - → PbCl 2 | K 2 = 14,45 |
| PbCl 2 + Cl - → PbCl 3 - | K 3 = 3,98 × 10 −1 |
| PbCl 3 - + Cl - → PbCl 4 2− | K 4 = 8,92 × 10 −2 |
Organolead
Os compostos mais conhecidos são os dois derivados de plumbano mais simples : tetrametilead (TML) e tetraetilead (TEL); no entanto, os homólogos destes, bem como hexaethyldilead (HEDL), são de menor estabilidade. Os derivados de tetralquil contêm chumbo (IV); as ligações Pb-C são covalentes. Assim, eles se assemelham a compostos orgânicos típicos.
O chumbo forma prontamente uma liga equimolar com sódio metálico que reage com halogenetos de alquila para formar compostos organometálicos de chumbo, como tetraetila chumbo . As energias da ligação Pb-C em TML e TEL são apenas 167 e 145 kJ / mol; os compostos assim se decompõem com o aquecimento, com os primeiros sinais da composição TEL vistos a 100 ° C (210 ° F). A pirólise produz chumbo elementar e radicais alquil; sua inter-reação causa a síntese de HEDL. Eles também se decompõem com a luz solar ou ultravioleta. Na presença de cloro, os alquilos começam a ser substituídos por cloretos; o R 2 PbCl 2 na presença de HCl (um subproduto da reação anterior) leva à mineralização completa para dar PbCl 2 . A reação com o bromo segue o mesmo princípio.
Diagramas de fase de solubilidades
O sulfato de chumbo (II) é pouco solúvel, como pode ser visto no diagrama a seguir, mostrando a adição de SO 4 2− a uma solução contendo 0,1 M de Pb 2+ . O pH da solução é 4,5, pois acima disso, a concentração de Pb 2+ nunca pode chegar a 0,1 M devido à formação de Pb (OH) 2 . Observe que a solubilidade do Pb 2+ cai 10.000 vezes quando o SO 4 2− atinge 0,1 M.

|
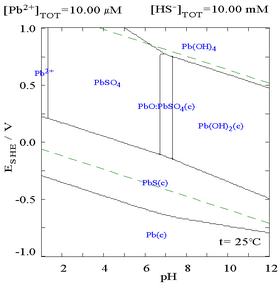
|
| Gráfico mostrando a concentração aquosa de Pb 2+ dissolvido em função de SO 4 2− | Diagrama para chumbo em meio de sulfato |
A adição de cloreto pode diminuir a solubilidade do chumbo, embora em meios ricos em cloreto (como água régia ) o chumbo possa se tornar solúvel novamente como cloro-complexos aniônicos.

|
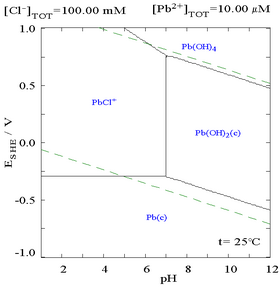
|
| Diagrama mostrando a solubilidade do chumbo em meio de cloreto. As concentrações de chumbo são representadas graficamente como uma função do cloreto total presente. | Diagrama de Pourbaix para chumbo em meio de cloreto (0,1 M) |
Referências
Bibliografia
Polyanskiy, NG (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [ Química analítica dos elementos: chumbo ] (em russo). Nauka .

