Antagonista do receptor CCR5 - CCR5 receptor antagonist
Os antagonistas do receptor CCR5 são uma classe de pequenas moléculas que antagonizam o receptor CCR5 . O receptor de quimiocina CCR5 está envolvido no processo pelo qual o HIV , o vírus que causa a AIDS , entra nas células. Portanto, os antagonistas deste receptor são inibidores de entrada e têm potenciais aplicações terapêuticas no tratamento de infecções por HIV.
O ciclo de vida do HIV apresenta alvos potenciais para a terapia medicamentosa, sendo um deles a via de entrada do vírus. CCR5 e CXCR4 são os principais receptores envolvidos no processo de entrada do HIV. Esses receptores pertencem à família de sete receptores acoplados à proteína G transmembrana ( GPCR ) e são predominantemente expressos em células T humanas , células dendríticas e macrófagos , células de Langerhans . Eles desempenham um papel importante como co-receptores que o HIV tipo 1 (HIV-1) usa para se ligar às células antes da fusão viral e entrada nas células hospedeiras. Os isolados de HIV podem ser divididos em cepas R5 e X4. A cepa R5 é quando o vírus usa o co-receptor CCR5 e a cepa X4 é quando usa o CXCR4. A localização dos receptores CCR5 na superfície celular, tanto as moléculas grandes quanto as pequenas, têm o potencial de interferir na interação do vírus CCR5 e inibir a entrada do vírus nas células humanas.
História
Desde a descoberta do HIV na década de 1980, um progresso notável foi feito no desenvolvimento de novos medicamentos antivirais . O gatilho para a descoberta dos antagonistas do CCR5 foi a observação de que uma pequena porcentagem das populações de alto risco apresentava resistência ou atraso no desenvolvimento da doença. Descobriu-se que esta população tinha uma mutação (CCR5-Δ32) no gene que codifica o receptor CCR5, que resulta em resistência quase completa contra a infecção por HIV-1 e os cientistas descobriram o papel fundamental dos receptores de superfície celular CCR5 e CXCR4 no sucesso fusão viral e infecção. Em 1996, foi demonstrado que o CCR5 serve como um co-receptor para as cepas de HIV-1 mais comumente transmitidas, R5. Este tipo de vírus é predominante durante os estágios iniciais da infecção e permanece a forma dominante em mais de 50% dos pacientes infectados com HIV-1 em estágio avançado, no entanto, as cepas R5 podem eventualmente evoluir para X4 conforme a doença progride. Essas informações levaram ao desenvolvimento de uma nova classe de medicamentos para o HIV, denominados antagonistas do CCR5.
Mecanismo de ação
O HIV entra nas células hospedeiras no sangue ligando-se a receptores na superfície da célula CD4 + . A entrada viral na célula CD4 + começa com a ligação da glicoproteína 120 R5 HIV-1 ( gp120 ) ao receptor da célula T CD4 +, que produz uma mudança conformacional na gp120 e permite que ela se ligue ao CCR5, desencadeando assim a glicoproteína 41 ( gp41 ) fusão mediada do envelope viral com a membrana celular e o nucleocapsídeo entra na célula hospedeira (Figura 1). Os antagonistas do co-receptor CCR5 impedem que o HIV-1 entre e infecte as células do sistema imunológico ao bloquear o receptor de superfície celular CCR5. Antagonistas de moléculas pequenas do CCR5 ligam-se a uma bolsa hidrofóbica formada pelas hélices transmembrana do receptor CCR5. Acredita-se que eles interajam com o receptor de maneira alostérica , travando o receptor em uma conformação que proíbe sua função de co-receptor.
Desenvolvimento de drogas
Como mencionado, o receptor CCR5 é um receptor acoplado à proteína G (GPCR). Antes da descoberta do papel do CCR5 na infecção pelo HIV, muitas empresas farmacêuticas já haviam construído uma coleção substancial de compostos que têm como alvo os GPCRs. Alguns desses compostos provariam ser um ponto de partida para a química medicinal do antagonista do CCR5 , mas precisariam de otimização para melhorar a seletividade e a potência do CCR5 e para melhorar as propriedades farmacocinéticas . Um problema significativo era a afinidade dos resultados de triagem disponíveis para o canal de íons hERG ; a inibição de hERG leva ao prolongamento do intervalo QT , o que pode aumentar o risco de desenvolvimento de arritmias ventriculares fatais . Muitos antagonistas do CCR5 foram estudados por empresas farmacêuticas, mas poucos deles realmente alcançaram estudos de eficácia em humanos; por exemplo , AstraZeneca , Novartis , Merck e Takeda usaram suas coleções de compostos direcionados a GPRC para desenvolver um potente antagonista CCR5, mas nenhum deles chegou a ensaios clínicos. Três empresas farmacêuticas competiram para serem as primeiras a ter um antagonista de CCR5 de molécula pequena aprovado: GlaxoSmithKline (GSK) com seu composto aplaviroc , Schering-Plough com vicriviroc e Pfizer com maraviroc . Todos os compostos alcançaram testes clínicos em humanos; apenas maraviroc foi aprovado pela US Food and Drug Administration (FDA).
Leronlimab
Leronlimab é um anticorpo monoclonal humanizado direcionado contra o receptor CCR5 encontrado em linfócitos T do sistema imunológico humano e em muitos tipos de câncer. Está sendo investigado como uma terapia potencial no tratamento de infecção por HIV , doença do enxerto contra hospedeiro (NCT02737306) e câncer metastático (NCT03838367). A Food and Drug Administration (FDA) dos Estados Unidos designou leronlimab para aprovação rápida . Em fevereiro de 2008, a droga entrou nos ensaios clínicos de Fase 2 e um ensaio de fase 3 foi iniciado em 2015. Em fevereiro de 2018, CytoDyn Inc relatou que o desfecho primário foi alcançado no ensaio de terapia combinada principal PRO 140 na infecção por HIV.
Leronlimab está sendo desenvolvido pela CytoDyn Inc. Em maio de 2007, os resultados do ensaio clínico de fase I da droga demonstraram "atividade antiviral potente, rápida, prolongada, dependente da dose e altamente significativa" para leronlimab. Os participantes do grupo de dosagem mais alta receberam 5 miligramas por quilograma e mostraram uma diminuição média da carga viral de -1,83 log 10 . Em média, reduções superiores a -1 log 10 por mililitro foram mantidas por entre duas e três semanas, com uma única dose do medicamento. As maiores reduções individuais de RNA do HIV variaram até -2,5 log 10 entre os pacientes que receberam as doses de 2 e 5 mg / kg.
Leronlimab é um anticorpo feito em laboratório que funciona como um inibidor de entrada . Leronlimab se liga ao receptor CCR5 nas células CD4 e interfere na capacidade do HIV de entrar na célula. Leronlimab, uma forma humanizada de um anticorpo PA14, é um anticorpo monoclonal do receptor de quimiocina CCR5 e pode inibir o HIV-1 com tropismo para o CCR5 em concentrações que não antagonizam a atividade natural do CCR5 in vitro. A entrada do HIV-1 é mediada pelas glicoproteínas do envelope do HIV-1 gp120 e gp41. A gp120 se ligará ao CD4 e à molécula do receptor CCR5co, e isso desencadeia a fusão mediada pela gp41 das membranas viral e celular. O CCR5 é, portanto, necessário para a entrada do vírus e para a infecção de células saudáveis. Leronlimab, o anticorpo monoclonal anti-CCR5, pode impedir que o HIV entre na célula e interromper a replicação viral. Impede a ligação do vírus à célula em um local distinto no co-receptor CCR5 sem interferir com sua atividade natural. Ao contrário de outros inibidores de entrada, PRO 140 é um anticorpo monoclonal. O mecanismo de inibição é competitivo e não alostérico . Como tal, deve ser injetado para ser eficaz. No entanto, uma vez dentro do corpo, o PRO 140 liga-se ao CCR5 por> 60 dias, o que pode permitir uma dosagem tão rara como em semanas alternadas. Em comparação com a terapia anti-retroviral altamente ativa, que demonstrou ter toxicidades relacionadas ao tratamento para pacientes infectados pelo HIV, o PRO140 não tem resistência a múltiplos medicamentos ou toxicidades.
Em fevereiro de 2018, CytoDyn relatou que o desfecho primário foi alcançado no ensaio de terapia de combinação principal do PRO 140 na infecção por HIV e continuará por mais 24 semanas (final de agosto de 2018) com PRO 140 injeções subcutâneas semanais e TARV otimizado. O relatório revela que uma única injeção subcutânea de 350 mg de PRO 140 resultou em uma redução da carga viral de RNA do HIV-1 superior a 0,5log ou 68% em uma semana em comparação com aqueles que receberam um placebo . Os resultados do endpoint primário de eficácia foram apresentados no ASM Microbe 2018. No ensaio principal de leronlimab em combinação com terapias anti-retrovirais padrão em pacientes infectados com HIV com experiência em tratamento, 81% dos pacientes que completaram o ensaio alcançaram supressão da carga viral do HIV de <50 cp / mL. Os medicamentos aprovados recentemente para esta população variam de 43% após 24 semanas a 45% após 48 semanas, com supressão da carga viral de <50 cp / mL. Em março de 2019, CytoDyn protocolou junto ao FDA dos EUA a primeira parte do BLA para leronlimab (PRO140) como terapia combinada com HAART no HIV. Em maio de 2020, a empresa apresentou seu BLA com potencial aprovação do FDA no 4T'20. CytoDyn está conduzindo um ensaio investigativo de monoterapia de leronlimab (PRO140) para HIV. Se bem-sucedido, leronlimab auto-administrado uma vez por semana representaria uma mudança de paradigma no tratamento do HIV.
CytoDyn está investigando o uso de leronlimab em vários tumores sólidos. Em 18 de fevereiro de 2019, a CytoDyn anunciou que iniciará 8 estudos pré-clínicos sobre câncer de melanoma, câncer de pâncreas, mama, próstata, cólon, pulmão, fígado e estômago. Isso tem o potencial de levar a 8 estudos clínicos de fase II com leronlimab na arena do câncer. Em 23 de novembro de 2018, CytoDyn recebeu a aprovação do FDA de sua submissão IND e permitiu iniciar um ensaio clínico de Fase Ib / II para pacientes com câncer de mama triplo-negativo metastático (mTNBC). Em 20 de fevereiro de 2019, CytoDyn anunciou que leronlimab foi capaz de reduzir em mais de 98% a incidência de metástase de câncer de mama humano em um modelo de xenoenxerto de camundongo para câncer por seis semanas com leronlimab. A equivalência temporal do estudo murino de 6 semanas pode ser de até 6 anos em humanos. Em maio de 2019, a Food and Drug Administration (FDA) dos EUA concedeu a designação acelerada para leronlimab para uso em combinação com carboplatina para o tratamento de pacientes com CCR5-positivo mTNBC. Em julho de 2019, CytoDyn anunciou a dosagem do primeiro paciente mTNBC sob uso compassivo. Simultaneamente, o ensaio de Fase Ib / II para pacientes com mTNBC virgens de tratamento está ativo e antecipa dados de primeira linha em 2020. Se for bem-sucedido, os dados de pacientes com mTNBC virgens de tratamento podem servir como base para a busca de uma aprovação acelerada do FDA dos EUA.
Um estudo demonstrou que leronlimab reduziu o número e o tamanho de novas metástases de câncer de mama humano em um modelo de camundongo e reduziu o tamanho da metástase estabelecida, estendendo assim a sobrevivência.
Em maio de 2019, CytoDyn iniciou o estudo pré-clínico de leronlimab para prevenir NASH.
Aplaviroc
Aplaviroc é originado de uma classe de derivados da espirodicetopiperazina. A Figura 2 mostra a estrutura molecular do composto principal e do composto final aplaviroc. O composto principal mostrou boa potência no bloqueio de CCR5 em várias cepas de HIV R5 e contra cepas resistentes a múltiplos fármacos. O problema com este composto não era sua seletividade CCR5, mas a biodisponibilidade oral. Isso levou a um maior desenvolvimento da molécula e o resultado foi um composto denominado aplaviroc. Infelizmente, apesar dos promissores resultados pré-clínicos e clínicos iniciais, alguma toxicidade hepática grave foi observada no tratamento de pacientes virgens de tratamento e com experiência de tratamento, o que levou à interrupção do desenvolvimento de aplaviroc.
Vicriviroc
A Schering-Plough identificou um composto ativo durante a triagem. A Figura 3 mostra a estrutura molecular do composto principal, do composto intermediário e do composto final vicriviroc . O composto principal continha uma piperazina andaime e foi um potente do receptor muscarínico de acetilcolina (H 2 ) com actividade antagonista de CCR5 modesto. As mudanças que foram feitas no lado esquerdo do composto principal e a adição de um grupo metil no grupo piperazina (( S ) -metilpiperazina) resultaram no composto intermediário que tinha boa afinidade para receptores CCR5, mas muito pouca afinidade para muscarínico atividade, no entanto, o composto mostrou afinidade para o canal iônico hERG. A reconstrução posterior levou ao desenvolvimento do vicriviroc composto final, quando Schering descobriu que o N- óxido de piridil no intermediário poderia ser substituído por 4,6-dimetilpirimidina carboxamida. O vicriviroc teve uma excelente seletividade para receptores CCR5 em relação aos muscarínicos e a afinidade hERG foi bastante reduzida. O ensaio clínico de fase I do vicriviroc apresentou resultados promissores, portanto, foi iniciado um estudo de fase II no tratamento de pacientes virgens de tratamento. O estudo de fase II foi descontinuado porque houve um avanço viral no grupo do vicriviroc em comparação com o grupo de controle . Esses resultados sugeriram que o vicriviroc não foi eficaz no tratamento de pacientes virgens de tratamento em comparação com os tratamentos atuais. Outro estudo clínico de fase II foi realizado em pacientes experientes em tratamento. Os resultados foram que o vicriviroc tinha forte atividade antiviral, mas foram relatados cinco casos de câncer entre os participantes; no entanto, o estudo continuou, pois não havia associação causal das doenças malignas e do vicriviroc. No final de 2009, a empresa informou que o vicriviroc entrou em estudos de fase II no tratamento de pacientes virgens de tratamento e em estudos de fase III em pacientes com experiência de tratamento.
Maraviroc
A Pfizer voltou-se para a triagem de alto rendimento em sua busca por um bom ponto de partida para um antagonista de CCR5 de molécula pequena. A triagem resultou em um composto que apresentou afinidade fraca e nenhuma atividade antiviral, mas representou um bom ponto de partida para otimização posterior. Os compostos 1–9 na Tabela 1 mostram o desenvolvimento de maraviroc em poucas etapas. A estrutura química da molécula de partida (UK-107.543) é apresentada como composto 1 . Seu primeiro foco foi minimizar a atividade do CYP2D6 da molécula e reduzir sua lipofilicidade . Eles substituíram a imidazopiridina por benzimidazol e o grupo benzidrila foi trocado por uma benzamida . O resultado foi o composto 2 . Esse composto apresentou boa potência de ligação e início de atividade antiviral. A otimização da relação estrutura-atividade (SAR) adicional da região da amida e a identificação da preferência enantiomérica levaram à estrutura da ciclobutil amida no composto 3 . No entanto, o problema com a atividade CYP2D6 do composto ainda era inaceitável, então eles tiveram que realizar uma otimização SAR adicional que determinou que a [3.2.1] -azabicicloamina ( tropano ) poderia substituir a porção aminopiperidina. Essa mudança na estrutura química levou ao composto 4 . O Composto 4 não teve atividade CYP2D6, embora preservando excelente afinidade de ligação e atividade antiviral. Embora o composto 4 tenha mostrado resultados promissores, ele demonstrou 99% de inibição no canal de íons hERG . Essa inibição era inaceitável, pois pode levar ao prolongamento do intervalo QTc . A equipe de pesquisa então fez algumas modificações para ver qual parte da molécula desempenhava um papel na afinidade hERG. O Composto 5 mostra um análogo que eles sintetizaram que continha uma ponte de oxigênio no anel de tropano; no entanto, essa reconstrução não teve efeito sobre a afinidade hERG. Eles então se concentraram na área da superfície polar na molécula para determinar a afinidade hERG. Esses esforços resultaram no composto 6 . Esse composto preservou a atividade antiviral desejada e foi seletivo contra a inibição de hERG, mas o problema era sua biodisponibilidade . A redução na lipofilicidade, por meio da substituição do grupo benzimidazol por um grupo triazol substituído, deu o composto 7 . O composto 7 mostrou uma redução significativa na lipofilicidade e manteve a atividade antiviral, mas novamente, com a introdução de um grupo ciclobutila, o composto mostrou inibição de hERG. Alterar o tamanho do anel no composto 7 de uma unidade ciclobutila para uma unidade ciclopentila no composto 8 levou a um aumento significativo na atividade antiviral e perda de afinidade hERG. O desenvolvimento posterior levou à descoberta de uma 4,4'-difluorociclohexilamida, também conhecida como maraviroc. Maraviroc preservou excelente atividade antiviral, embora não demonstrando afinidade de ligação significativa ao hERG. A falta de afinidade de ligação de hERG foi prevista como sendo devido ao grande tamanho do grupo ciclohexila e a alta polaridade dos substituintes de flúor. Em agosto de 2007, o FDA aprovou o primeiro antagonista CCR5, maraviroc, descoberto e desenvolvido pela Pfizer.
Farmacóforo
O modelo de farmacóforo preditivo foi desenvolvido para uma grande série de antagonistas CCR5 à base de piperidina e piperazina pelo Schering-Plough Research Institute. A hipótese deles consistia principalmente em cinco características, dois aceitadores de ligação de hidrogênio, marcados C e D na figura 4 e três grupos hidrofóbicos, A, B e E na figura 4. A parte B geralmente tem um grupo de nitrogênio básico. O modelo foi validado usando diversos conjuntos de seis antagonistas CCR5 de cinco empresas farmacêuticas diferentes. O melhor modelo previu corretamente esses compostos como sendo altamente ativos. É possível usar o modelo como uma ferramenta na triagem virtual de novos antagonistas de CCR5 moleculares pequenos e também para prever atividades biológicas de compostos antes de realizar sua síntese dispendiosa.
Obrigatório
O CCR5 é um membro de sete receptores de segmento transmembrana acoplados à proteína G. A estrutura do receptor compreende feixe de sete hélices na região transmembranar, essas regiões são rotuladas I-VII nas figuras 5 e 6 . Prevê-se que os antagonistas CCR5 se liguem a uma bolsa de ligação putativa que está enterrada dentro do domínio transmembranar, delimitado pelas sete hélices transmembranares. A bolsa de ligação é muito hidrofóbica, com vários resíduos aromáticos revestindo a bolsa. Os resíduos-chave são triptofano 86 e 248 (Trp86, Trp248), tirosina 108 e 251 (Tyr108, Tyr251), fenilalanina 109 (Phe109), treonina 195 (Thr195), isoleucina 198 (Ile198), ácido glutâmico 283 (Glu283). Os antagonistas CCR5 são muito diferentes em forma e potencial eletrostático, embora todos compartilhem a mesma bolsa de ligação. O interessante sobre a ligação dessas moléculas é que elas exibem modos de ligação significativamente diferentes, embora todas estabeleçam uma extensa rede de interação com o CCR5.
Aplaviroc
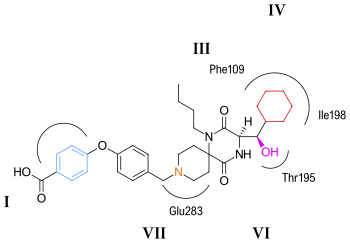
O modo de ligação putativo para aplaviroc é mostrado na figura 5 . Prevê-se que a interação chave de ponte salgada entre aplaviroc e Glu283 seja bastante fraca em comparação com outros antagonistas CCR5. O grupo hidroxila no aplaviroc forma uma forte ligação de hidrogênio ao resíduo polar Thr195. Esta interação da ligação H é mais forte com aplaviroc em comparação com outros antagonistas CCR5. Prevê-se que o grupo ciclohexil na estrutura do aplaviroc interaja com o receptor em uma bolsa hidrofóbica formada por Ile198, Thr195 e Phe109 e acredita-se que apresente interações hidrofóbicas bastante fortes. Os pesquisadores preveem que o grupo butil do aplaviroc está enterrado no feixe helicoidal por meio de uma forte interação hidrofóbica com vários resíduos aromáticos do receptor CCR5. Aplaviroc tem uma característica única de preservar dois dos ligantes naturais da proteína quimiocina que se ligam ao CCR5 e ativação subsequente, enquanto o maraviroc e os outros antagonistas bloqueiam quase totalmente as interações quimiocina-CCR5. Este tipo de interferência é até agora considerado seguro, e os indivíduos que naturalmente não têm CCR5 não apresentam problemas de saúde óbvios. No entanto, para limitar a toxicidade e os efeitos colaterais dos antagonistas do CCR5, seria ideal ser capaz de preservar a função do receptor de quimiocina. Consequentemente, deve ser de interesse projetar inibidores que rompam especificamente a ligação CCR5-gp120, mas não afetam a ativação da quimiocina CCR5.
Maraviroc
O modo de ligação putativo para maraviroc é mostrado na figura 6 . Estima-se que a interação mais forte seja entre maraviroc e ácido glutâmico (Glu283) por meio de uma forte interação de ponte de sal. A interação entre o triptofano (Trp86) e o maraviroc envolve o empilhamento π-π em forma de T, enquanto a interação com a fenilalanina (Phe109) é considerada hidrofóbica. Pensa-se que a tirosina (Tyr108) interage com o grupo fenil no maraviroc através de uma interação paralela deslocada. Prevê-se que a interação entre maraviroc e isoleucina (Ile198) seja principalmente de natureza hidrofóbica e a interação entre maraviroc e tirosina (Tyr251) é muito limitada.
Outros antagonistas CCR5
O desenvolvimento de novos antagonistas do CCR5 continua, tanto por seus efeitos antivirais quanto por sua utilidade potencial em uma variedade de indicações autoimunes . Pesquisadores da Roche Palo Alto descobriram uma nova série de potentes antagonistas de moléculas pequenas do CCR5. A otimização do chumbo foi buscada equilibrando tendências opostas de estabilidade metabólica e potência. A combinação do modelo de espiropiperidina com elementos farmacóforos de aplaviroc e do programa de antagonista CCR5 da Schering levou ao composto principal inicial desta série. O desenvolvimento posterior desse composto principal levou à descoberta do composto A na figura 7 - um composto que possui uma boa seletividade e propriedades farmacocinéticas.
O antagonista CCR5 INCB009471 tem atividade nanomolar contra o HIV-1 in vitro . Este composto demonstrou atividade antiviral potente e prolongada contra HIV-1 com tropismo para R5 quando administrado em dose de 200 mg uma vez ao dia por 14 dias. Essas descobertas apoiaram o desenvolvimento clínico do INCB009471 e, desde então, progrediram para os ensaios clínicos de fase IIb. Em 2009, o estudo deste composto está inativo e nenhum outro estudo está planejado no momento.
Não apenas pequenas moléculas, mas também proteínas distribuídas por terapia genética têm sido sugeridas para ablacionar a função CCR5, uma abordagem que também tem sido empregada para outros alvos do HIV.
Veja também
- Cenicriviroc
- CD4
- CCL5
- CCR5
- Subtipos de HIV
- Tropismo de HIV
- Descoberta e desenvolvimento de inibidores não nucleosídeos da transcriptase reversa
- Descoberta e desenvolvimento de inibidores da transcriptase reversa de nucleosídeos e nucleotídeos