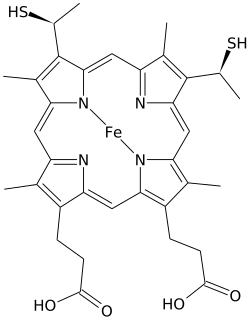
Heme C - Heme C
|
|
| Identificadores | |
|---|---|
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| Malha | heme + C |
|
PubChem CID
|
|
|
|
|
|
| Propriedades | |
| C 34 H 36 O 4 N 4 S 2 Fe | |
| Massa molar | 684,64904 g / mol |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Heme C (ou heme C ) é um tipo importante de heme .
História
A estrutura correta do heme C foi publicada, em meados do século 20, pelo bioquímico sueco K.-G. Paulo. Este trabalho confirmou a estrutura inicialmente inferida pelo grande bioquímico sueco Hugo Theorell . A estrutura do heme C, com base em experimentos de RMN e IV da forma reduzida de Fe (II), do heme, foi confirmada em 1975. A estrutura do heme C, incluindo a configuração estereoquímica absoluta sobre as ligações tioéter, foi apresentada pela primeira vez para o proteína de vertebrado, citocromo ce agora é estendida a muitas outras proteínas contendo heme C.
Propriedades
O heme C difere do heme B porque as duas cadeias laterais de vinil do heme B são substituídas por ligações covalentes de tioéter à apoproteína . As duas ligações tioéter são tipicamente feitas por resíduos de cisteína da proteína. Essas ligações não permitem que o heme C se dissocie facilmente da holoproteína , citocromo c , em comparação com o heme B mais facilmente dissociado que pode se dissociar da holoproteína, o complexo heme-proteína, mesmo em condições moderadas. Isso permite uma gama muito ampla de estrutura e função do citocromo C, com uma miríade de citocromos do tipo C atuando principalmente como transportadores de elétrons. O potencial redox para o citocromo c também pode ser "ajustado" por pequenas mudanças na estrutura da proteína e na interação do solvente.
O número de unidades heme C ligadas a uma holoproteína é altamente variável. Para células de vertebrados, um heme C por proteína é a regra, mas para bactérias esse número costuma ser 2, 4, 5, 6 ou mesmo 16 grupos heme C por holoproteína. É geralmente aceito que o número e a disposição dos grupos heme C são relacionados e até mesmo necessários para o funcionamento adequado da holoproteína. Por exemplo, aquelas proteínas contendo vários grupos heme C estão envolvidas com múltiplas reações de transferência de elétrons, particularmente importante é a redução de 6 elétrons necessária para reduzir o nitrogênio atmosférico em duas moléculas de amônia orgânica. É comum que a razão heme C para aminoácidos seja alta para hemeproteínas bacterianas , de modo que o interior de algumas proteínas do citocromo C parece embalado com muitos grupos heme C em comparação com outras hemeproteínas. Algumas hemeproteínas, geralmente de organismos unicelulares , podem conter cinco hemes C. O complexo bc 1 é outra enzima importante que contém um heme do tipo C.
As ligações tioéter parecem permitir uma grande liberdade de função para as holoproteínas. Em geral, os citocromos do tipo c podem ser "ajustados" em uma faixa mais ampla de potencial de oxidação-redução do que os citocromos b. Esta pode ser uma razão importante pela qual o citocromo c é quase onipresente ao longo da vida. O heme C também desempenha um papel importante na apoptose, onde apenas algumas moléculas do citocromo c citoplasmático, que ainda deve conter heme C, levam à morte celular programada. O citocromo c pode ser medido no soro humano e pode ser usado como um marcador de inflamação.
Além dessas ligações covalentes equatoriais, o ferro heme também é geralmente coordenado axialmente às cadeias laterais de dois aminoácidos , tornando o ferro hexacoordenado. Por exemplo, o citocromo c de mamífero e atum contém um único heme C que é coordenado axialmente às cadeias laterais de histidina e metionina . Talvez por causa das duas ligações covalentes que prendem o heme à proteína, o ferro do heme C às vezes é ligado axialmente ao grupo amino da lisina ou mesmo à água.
Referências
- ^ Paul, KG; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof (1950). "A divisão com sais de prata das ligações cisteína-porfirina no citocromo c" . Acta Chemica Scandinavica . 4 : 239–244. doi : 10.3891 / acta.chem.scand.04-0239 .
- ^ Caughey, WS; Smythe, GA; O'Keeffe, DH; Maskasky, JE; Smith, ML (1975). "Heme A of Cytochrome c Oxidase" . Journal of Biological Chemistry . 250 (19): 7602–7622. doi : 10.1016 / S0021-9258 (19) 40860-0 . PMID 170266 .
- ^ Takano T .; Trus BL; Mandel N .; Mandel G .; Kallai OB; Swanson R .; Dickerson RE (1977). "Atum citocromo c com resolução de 2.0 A. II. Análise da estrutura do ferrocitocromo" . Journal of Biological Chemistry . 252 (2): 776–785. doi : 10.1016 / S0021-9258 (17) 32784-9 . PMID 188826 .
- ^ Berghuis, AM; Brayer, GD (1992). "Alterações conformacionais dependentes do estado de oxidação no citocromo c.". J. Mol. Biol . 223 (4): 959–976. doi : 10.1016 / 0022-2836 (92) 90255-i . PMID 1311391 .
- ^ Gwyer James D., Richardson David J., Butt Julea N. (2005). "Características de diodo ou diodo-túnel? Resolvendo as consequências catalíticas da transferência de elétrons acoplados a prótons em uma oxidorredutase multicentrada". Journal of the American Chemical Society . 127 (43): 14964–14965. doi : 10.1021 / ja054160s . PMID 16248601 .CS1 maint: vários nomes: lista de autores ( link )
- ^ Bowman, SEJ, Bren, KL (2008). "A química e a bioquímica do heme C: bases funcionais para a fixação covalente" . Nat. Prod. Rep . 25 (6): 1118–1130. doi : 10.1039 / b717196j . PMC 2654777 . PMID 19030605 .CS1 maint: vários nomes: lista de autores ( link )
- ^ Eleftheriadis, T .; Pissas, G .; Liakopoulos, V .; Stafanidis, I. (2016). "Citocromo c como um marcador potencialmente útil clínico de danos mitocondriais e celulares" . Frente. Immunol . 7 : 279. doi : 10.3389 / fimmu.2016.00279 . PMC 4951490 . PMID 27489552 .
- ^ Yeh, SR, Han, S. e Rousseau, DL (1998). "Dobragem e desdobramento do citocromo c". Contas de pesquisa química . 31 (11): 727–735. doi : 10.1021 / ar970084p .CS1 maint: vários nomes: lista de autores ( link )
