Miristoilação - Myristoylation
A miristoilação é uma modificação de lipidação em que um grupo miristoil , derivado do ácido mirístico , é covalentemente ligado por uma ligação amida ao grupo alfa-amino de um resíduo de glicina N-terminal . O ácido mirístico é um ácido graxo saturado de 14 carbonos (14: 0) com o nome sistemático de ácido n- tetradecanóico. Esta modificação pode ser adicionada tanto co-tradução ou pós-tradução . A N-miristoiltransferase (NMT) catalisa a reação de adição de ácido mirístico no citoplasma das células. Este evento de lipidação é o tipo de acilação gordurosa mais encontrado e é comum entre muitos organismos, incluindo animais , plantas , fungos , protozoários e vírus . A miristoilação permite interações proteína-proteína e proteína-lipídio fracas e desempenha um papel essencial no direcionamento de membrana, interações proteína-proteína e funções amplamente em uma variedade de vias de transdução de sinal .
Descoberta
Em 1982, o laboratório de Koiti Titani identificou um "grupo de bloqueio N-terminal" na subunidade catalítica da proteína quinase dependente de AMP cíclico em vacas como n- Tetradecanoil. Quase simultaneamente no laboratório de Claude B. Klee, este mesmo grupo de bloqueio N-terminal foi posteriormente caracterizado como ácido mirístico. Ambos os laboratórios fizeram essa descoberta utilizando técnicas semelhantes: bombardeio atômico rápido , espectrometria de massa e cromatografia gasosa .
N-miristoiltransferase
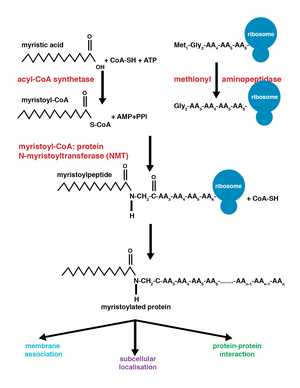
A enzima N-miristoiltransferase (NMT) ou glicilpeptídeo N-tetradecanoiltransferase é responsável pela adição irreversível de um grupo miristoila ao N-terminal ou resíduos internos de glicina de proteínas. Esta modificação pode ocorrer de forma co-traducional ou pós-tradução . Em vertebrados, esta modificação é realizada por dois NMTs, NMT1 e NMT2 , ambos membros da superfamília da acetiltransferase GCN5 .
Estrutura
A estrutura cristalina do NMT revela duas subunidades idênticas, cada uma com seu próprio sítio de ligação de miristoil CoA. Cada subunidade consiste em uma grande folha β em forma de sela rodeada por hélices α . A simetria da dobra é pseudo dupla. Myristoyl CoA se liga na porção N-terminal , enquanto a extremidade C-terminal se liga à proteína.
Mecanismo
A adição do grupo miristoil prossegue por meio de uma reação de adição-eliminação nucleofílica . Primeiro, a miristoil coenzima A (CoA) é posicionada em seu bolso de ligação de NMT de modo que a carbonila enfrente dois resíduos de aminoácidos, fenilalanina 170 e leucina 171. Isso polariza a carbonila de modo que haja uma carga líquida positiva no carbono, tornando-a suscetível a ataque nucleofílico pelo resíduo de glicina da proteína a ser modificada. Quando o miristoil CoA se liga, o NMT se reorienta para permitir a ligação do peptídeo. O terminal C do NMT atua então como uma base geral para desprotonar o NH 3 + , ativando o grupo amino para atacar o grupo carbonil do miristoil-CoA. O intermediário tetraédrico resultante é estabilizado pela interação entre um orifício de oxiânion carregado positivamente e o ânion alcóxido carregado negativamente . O CoA livre é então liberado, causando uma mudança conformacional na enzima que permite a liberação do peptídeo miristoilado.
Adição co-tradução vs. pós-tradução
As modificações covalentes co-traducionais e pós-traducionais permitem que as proteínas desenvolvam níveis mais elevados de complexidade na função celular, adicionando ainda mais diversidade ao proteoma . A adição de miristoil-CoA a uma proteína pode ocorrer durante ou após a tradução da proteína. Durante a adição co-tradução do grupo miristoil, a glicina N-terminal é modificada após clivagem do resíduo de metionina N-terminal no polipeptídeo em crescimento de nova formação . A miristoilação pós-tradução normalmente ocorre após um evento de clivagem da caspase , resultando na exposição de um resíduo de glicina interno, que fica então disponível para adição de ácido mirístico.
Funções
Proteínas miristoiladas
| Proteína | Papel Fisiológico | Função de miristoilação |
|---|---|---|
| Actin | Proteína estrutural do citoesqueleto | Miristoilação pós-tradução durante a apoptose |
| Oferta | Proteína promotora de apoptose | A miristoilação pós-tradução após a clivagem da caspase direciona a proteína para a membrana mitocondrial |
| MARCAS | reticulação de actina quando fosforilada pela proteína quinase C | A miristoilação co-tradução auxilia na associação da membrana plasmática |
| Proteína G | Sinalização GTPase | A miristoilação co-tradução auxilia na associação da membrana plasmática |
| Gelsolin | Proteína de corte de filamento de actina | A miristoilação pós-tradução regula para cima as propriedades anti-apoptóticas |
| PAK2 | Crescimento de células de serina / treonina quinase , mobilidade, estimulador de sobrevivência | A miristoilação pós-tradução regula para cima as propriedades apoptóticas e induz a localização da membrana plasmática |
| Arf | tráfico vesicular e regulação da remodelação de actina | A miristoilação do terminal N auxilia na associação de membrana |
| Hipocalcina | Sensor neuronal de cálcio | Contém um interruptor Ca 2+ / miristoil |
Chave molecular de miristoilação
A miristoilação não apenas diversifica a função de uma proteína, mas também adiciona camadas de regulação a ela. Uma das funções mais comuns do grupo miristoila é a associação à membrana e a localização celular da proteína modificada. Embora o grupo miristoil seja adicionado ao final da proteína, em alguns casos ele é sequestrado dentro de regiões hidrofóbicas da proteína em vez de exposto ao solvente. Ao regular a orientação do grupo miristoila, esses processos podem ser altamente coordenados e controlados de perto. A miristoilação é, portanto, uma forma de " troca molecular ".
Ambos os grupos de miristoil hidrofóbicos e "manchas básicas" (regiões altamente positivas na proteína) caracterizam interruptores eletrostáticos de miristoil. O patch básico permite que interações eletrostáticas favoráveis ocorram entre as cabeças de fosfolipídios carregados negativamente da membrana e a superfície positiva da proteína associada. Isso permite uma associação mais estreita e localização direcionada de proteínas.
Os interruptores conformacionais com miristoil podem ter várias formas. A ligação do ligante a uma proteína miristoilada com seu grupo miristoila sequestrado pode causar uma mudança conformacional na proteína, resultando na exposição do grupo miristoila. Da mesma forma, algumas proteínas miristoiladas são ativadas não por um ligante designado, mas pela troca de GDP por GTP por fatores de troca de nucleotídeo guanina na célula. Uma vez que o GTP é ligado à proteína miristoilada, ele se torna ativado, expondo o grupo miristoil. Essas chaves conformacionais podem ser utilizadas como um sinal para a localização celular, membrana-proteína e interações proteína-proteína .
Modificações duplas de proteínas miristoiladas
Outras modificações nas proteínas N-miristoiladas podem adicionar outro nível de regulação para a proteína miristoilada. A acilação dupla pode facilitar a localização de proteínas mais rigidamente regulada, direcionando especificamente proteínas para jangadas de lipídios nas membranas ou permitindo a dissociação de proteínas miristoiladas das membranas.
A miristoilação e a palmitoilação são modificações comumente acopladas. A miristoilação por si só pode promover interações de membrana transitórias que permitem que as proteínas se ancorem às membranas, mas se dissociem facilmente. A palmitoilação posterior permite uma ancoragem mais firme e uma dissociação mais lenta das membranas quando exigido pela célula. Esta modificação dupla específica é importante para as vias do receptor acoplado à proteína G e é conhecida como o interruptor de acilação graxo duplo.
A miristoilação é freqüentemente seguida pela fosforilação de resíduos próximos. A fosforilação adicional da mesma proteína pode diminuir a afinidade eletrostática da proteína miristoilada para a membrana, causando a translocação dessa proteína para o citoplasma após a dissociação da membrana.
Transdução de sinal
A miristoilação desempenha um papel vital no direcionamento da membrana e na transdução de sinal nas respostas das plantas ao estresse ambiental. Além disso, na transdução de sinal via proteína G, palmitoilação da subunidade α, prenilação da subunidade γ e miristoilação está envolvida em amarrar a proteína G à superfície interna da membrana plasmática para que a proteína G possa interagir com seu receptor.
Apoptose
A miristoilação é parte integrante da apoptose ou morte celular programada. A apoptose é necessária para a homeostase celular e ocorre quando as células estão sob estresse, como hipóxia ou dano ao DNA . A apoptose pode ocorrer por ativação mitocondrial ou mediada por receptor. Na apoptose mediada por receptor, as vias apoptóticas são desencadeadas quando a célula se liga a um receptor de morte. Em um desses casos, a ligação ao receptor de morte inicia a formação do complexo de sinalização indutor de morte , um complexo composto de várias proteínas, incluindo várias caspases, incluindo a caspase 3 . A caspase 3 cliva várias proteínas que são subsequentemente miristoiladas por NMT. O agonista de morte de domínio pró-apoptótico que interage com BH3 (Bid) é uma dessas proteínas que, uma vez miristoilada, se transloca para a mitocôndria, onde induz a liberação de citocromo c levando à morte celular. Actina , gelsolina e quinase 2 ativada por p21 PAK2 são três outras proteínas que são miristoiladas após clivagem pela caspase 3 , o que leva à regulação para cima ou para baixo da apoptose.
Impacto na saúde humana
Câncer
c-Src é um gene que codifica para o proto-oncogene tirosina-proteína quinase Src, uma proteína importante para o ciclo mitótico normal. É fosforilado e desfosforilado para ligar e desligar a sinalização. O proto-oncogene tirosina-proteína quinase Src deve ser localizado na membrana plasmática para fosforilar outros alvos a jusante; a miristoilação é responsável por esteevento de direcionamento da membrana . O aumento da miristoilação de c-Src pode levar ao aumento da proliferação celular e ser responsável pela transformação de células normais em células cancerosas . A ativação de c-Src pode levar às chamadas marcas do câncer : regulação positiva da angiogênese , proliferação e invasão .
Infecciosidade viral
O HIV-1 é um retrovírus que depende da miristoilação de uma de suas proteínas estruturais para empacotar com sucesso seu genoma, montar e amadurecer em uma nova partícula infecciosa. A proteína da matriz viral , o domínio N-terminal da poliproteína gag, é miristoilada. Esta modificação de miristoilação tem como alvo a gag para a membrana da célula hospedeira. Utilizando o interruptor eletrostático miristoil, incluindo um patch básico na proteína da matriz, o gag pode se reunir em jangadas de lipídios na membrana plasmática para a montagem viral , brotamento e posterior maturação. Para prevenir a infecciosidade viral, a miristoilação da proteína da matriz pode se tornar um bom alvo para o fármaco.
Infecções procarióticas e eucarióticas
Certos NMTs são alvos terapêuticos para o desenvolvimento de medicamentos contra infecções bacterianas . A miristoilação tem se mostrado necessária para a sobrevivência de vários fungos causadores de doenças , entre eles C. albicans e C. neoformans . Além das bactérias procarióticas , os NMTs de vários organismos eucarióticos causadores de doenças também foram identificados como alvos de drogas . O funcionamento adequado do NMT nos protozoários Leishmania major e Leishmania donovani ( leishmaniose ), Trypanosoma brucei ( doença do sono africana ) e P. falciparum ( malária ) é necessário para a sobrevivência dos parasitas. Os inibidores desses organismos estão sob investigação. Foi identificado um inibidor da pirazol sulfonamida que se liga seletivamente ao T. brucei , competindo pelo sítio de ligação do peptídeo , inibindo assim a atividade enzimática e eliminando o parasita da corrente sanguínea de camundongos com a doença do sono africana .
Veja também
Referências
- ^ a b Cox, David L. Nelson, Michael M. (2005). Princípios de bioquímica de Lehninger (4ª ed.). Nova York: WH Freeman. ISBN 978-0716743392.
- ^ a b Tamanoi, editado por Fuyuhiko; Sigman, David S. (2001). Lipidação de proteínas (3ª ed.). San Diego, CA: Academic Press. ISBN 978-0-12-122722-7.Manutenção de CS1: texto extra: lista de autores ( link )
- ^ Mohammadzadeh, Fatemeh; Hosseini, Vahid; Mehdizadeh, Amir; Dani, Christian; Darabi, Masoud (30/11/2018). "Um método para a análise bruta da acilação global de proteínas por cromatografia gás-líquido" . IUBMB Life . 71 (3): 340–346. doi : 10.1002 / iub.1975 . ISSN 1521-6543 . PMID 30501005 .
- ^ Kara, UA; Stenzel, DJ; Ingram, LT; Bushell, GR; Lopez, JA; Kidson, C (abril de 1988). "Anticorpo monoclonal inibitório contra um antígeno de pequeno peso molecular (miristilado) de Plasmodium falciparum associado com a membrana de vacúolo parasitóforo" . Infecção e imunidade . 56 (4): 903–9. doi : 10.1128 / IAI.56.4.903-909.1988 . PMC 259388 . PMID 3278984 .
- ^ a b c d e f g h Farazi, TA (29 de agosto de 2001). "The Biology and Enzymology of Protein N-Myristoylation" . Journal of Biological Chemistry . 276 (43): 39501–39504. doi : 10.1074 / jbc.R100042200 . PMID 11527981 .
- ^ a b Carr, SA; Biemann, K; Shoji, S; Parmelee, DC; Titani, K (outubro de 1982). "n-tetradecanoil é o grupo de bloqueio do terminal NH2 da subunidade catalítica da proteína quinase dependente de AMP cíclico do músculo cardíaco bovino" . Anais da Academia Nacional de Ciências dos Estados Unidos da América . 79 (20): 6128–31. Bibcode : 1982PNAS ... 79.6128C . doi : 10.1073 / pnas.79.20.6128 . PMC 347072 . PMID 6959104 .
- ^ a b Aitken, A; Cohen, P; Santikarn, S; Williams, DH; Calder, AG; Smith, A; Klee, CB (27 de dezembro de 1982). "Identificação do grupo de bloqueio do terminal NH2 da calcineurina B como ácido mirístico". FEBS Letters . 150 (2): 314–8. doi : 10.1016 / 0014-5793 (82) 80759-x . PMID 7160476 . S2CID 40889752 .
- ^ a b c d e f g h i j Martin, Dale DO; Beauchamp, Erwan; Berthiaume, Luc G. (janeiro de 2011). "Miristoilação pós-translacional: a gordura é importante na vida e morte celular". Biochimie . 93 (1): 18–31. doi : 10.1016 / j.biochi.2010.10.018 . PMID 21056615 .
- ^ a b Bhatnagar, RS; Fütterer, K; Waksman, G; Gordon, JI (23 de novembro de 1999). "The structure of myristoyl-CoA: protein N-myristoyltransferase". Biochimica et Biophysica Acta (BBA) - Biologia Molecular e Celular de Lipídios . 1441 (2–3): 162–72. doi : 10.1016 / s1388-1981 (99) 00155-9 . PMID 10570244 .
- ^ Snider, Jared. "Visão geral das modificações pós-tradução (PTMs)" . Thermo Scientific.
- ^ Chen, Katherine A .; Manning, David R. (2001). Regulação das proteínas G por modificação covalente " . Oncogene . 20 (13): 1643–1652. doi : 10.1038 / sj.onc.1204185 . PMID 11313912 .
- ^ a b c McLaughlin, Stuart; Aderem, Alan (julho de 1995). "O interruptor eletrostático-miristoil: um modulador de interação proteína-membrana reversível". Tendências em Ciências Bioquímicas . 20 (7): 272–276. doi : 10.1016 / S0968-0004 (00) 89042-8 . PMID 7667880 .
- ^ a b Wright, Megan H .; Heal, William P .; Mann, David J .; Tate, Edward W. (7 de novembro de 2009). "Miristoilação de proteínas na saúde e na doença" . Journal of Chemical Biology . 3 (1): 19–35. doi : 10.1007 / s12154-009-0032-8 . PMC 2816741 . PMID 19898886 .
- ^ Levental, Ilya; Grzybek, Michal; Simons, Kai (3 de agosto de 2010). Greasing their way: lipid modifications Determine Protein Association with Membrane Rafts ". Bioquímica . 49 (30): 6305–6316. doi : 10.1021 / bi100882y . PMID 20583817 .
- ^ HAYASHI, Nobuhiro; TITANI, Koiti (2010). "Proteínas N-miristoiladas, componentes-chave em sistemas de transdução de sinal intracelular que permitem respostas celulares rápidas e flexíveis" . Anais da Academia Japão, Série B . 86 (5): 494–508. Bibcode : 2010PJAB ... 86..494H . doi : 10.2183 / pjab.86.494 . PMC 3108300 . PMID 20467215 .
- ^ Parede, marca A .; Coleman, David E .; Lee, Ethan; Iñiguez-Lluhi, Jorge A .; Posner, Bruce A .; Gilman, Alfred G .; Sprang, Stephen R. (dezembro de 1995). "A estrutura do heterotrímero de proteína G Giα1β1γ2" . Cell . 83 (6): 1047–1058. doi : 10.1016 / 0092-8674 (95) 90220-1 . PMID 8521505 .
- ^ a b Shoji, S; Kubota, Y (fevereiro de 1989). "[Função da miristoilação da proteína na regulação celular e proliferação viral]" . Yakugaku Zasshi . 109 (2): 71–85. doi : 10.1248 / yakushi1947.109.2_71 . PMID 2545855 .
- ^ Hanahan, Douglas; Weinberg, Robert A. (março de 2011). "Marcas do câncer: a próxima geração" . Cell . 144 (5): 646–674. doi : 10.1016 / j.cell.2011.02.013 . PMID 21376230 .
- ^ Hearps, AC; Jans, DA (março de 2007). "Regulando as funções da proteína da matriz do HIV-1". AIDS Research and Human Retroviruses . 23 (3): 341–6. doi : 10.1089 / aid.2006.0108 . PMID 17411366 .