Fosfofrutocinase 2 - Phosphofructokinase 2
| 6-fosfofruto-2-quinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dímero 6-fosfofruto-2-quinase, coração humano
| |||||||||
| Identificadores | |||||||||
| EC nº | 2.7.1.105 | ||||||||
| CAS no. | 78689-77-7 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
| 6PF2K | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura cristalina do fígado humano 6-fosfofruto-2-quinase / frutose-2,6-bisfosfatase
| |||||||||
| Identificadores | |||||||||
| Símbolo | 6PF2K | ||||||||
| Pfam | PF01591 | ||||||||
| Clã Pfam | CL0023 | ||||||||
| InterPro | IPR013079 | ||||||||
| PRÓSITO | PDOC00158 | ||||||||
| SCOP2 | 1bif / SCOPe / SUPFAM | ||||||||
| |||||||||
| 6-fosfofruto-2-quinase / frutose-bisfosfatase-2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
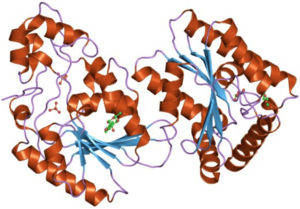
 Estrutura de PFK2. Exibido: domínio quinase (ciano) e domínio fosfatase (verde).
| |||||||||||
| Identificadores | |||||||||||
| Símbolo | 6PF2K | ||||||||||
| Pfam | PF01591 | ||||||||||
| InterPro | IPR013079 | ||||||||||
| PRÓSITO | PDOC00158 | ||||||||||
| SCOP2 | 1bif / SCOPe / SUPFAM | ||||||||||
| |||||||||||
| frutose-bisfosfatase-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | FBPase-2 | ||||||||
| Pfam | PF00316 | ||||||||
| InterPro | IPR028343 | ||||||||
| PRÓSITO | PDOC00114 | ||||||||
| |||||||||
A fosfofrutocinase-2 ( 6-fosfofruto-2-quinase , PFK-2 ) ou a frutose bifosfatase-2 ( FBPase-2 ), é uma enzima indiretamente responsável por regular as taxas de glicólise e gliconeogênese nas células. Catalisa a formação e degradação de um regulador alostérico significativo, frutose-2,6-bifosfato (Fru-2,6-P 2 ) a partir do substrato frutose-6-fosfato . Fru-2,6-P 2 contribui para a etapa determinante da taxa da glicólise, pois ativa a enzima fosfofrutocinase 1 na via da glicólise e inibe a frutose-1,6-bisfosfatase 1 na gliconeogênese. Uma vez que Fru-2,6-P 2 regula diferencialmente a glicólise e a gliconeogênese, pode atuar como um sinal chave para alternar entre as vias opostas. Como o PFK-2 produz Fru-2,6-P 2 em resposta à sinalização hormonal, o metabolismo pode ser controlado de forma mais sensível e eficiente para se alinhar às necessidades glicolíticas do organismo. Esta enzima participa do metabolismo da frutose e manose . A enzima é importante na regulação do metabolismo hepático de carboidratos e é encontrada em maiores quantidades no fígado, rins e coração . Em mamíferos, vários genes frequentemente codificam diferentes isoformas, cada uma das quais difere em sua distribuição nos tecidos e atividade enzimática . A família descrita aqui tem uma semelhança com as fosfo-frutocinases guiadas por ATP, no entanto, elas compartilham pouca similaridade de sequência , embora alguns resíduos pareçam ser a chave para sua interação com a frutose 6-fosfato .
A PFK-2 é conhecida como a "enzima bifuncional" por causa de sua estrutura notável: embora ambas estejam localizadas em um homodímero de proteína , seus dois domínios atuam como enzimas que funcionam independentemente. Um terminal atua como um domínio quinase (para PFK-2), enquanto o outro terminal atua como um domínio fosfatase (FBPase-2).
Em mamíferos, os mecanismos genéticos codificam diferentes isoformas de PFK-2 para acomodar as necessidades específicas dos tecidos. Embora a função geral permaneça a mesma, as isoformas apresentam pequenas diferenças nas propriedades enzimáticas e são controladas por diferentes métodos de regulação; essas diferenças são discutidas abaixo.
Estrutura
Os monômeros da proteína bifuncional são claramente divididos em dois domínios funcionais. O domínio quinase está localizado no N-terminal. É constituído por uma folha β central de seis fios, com cinco fios paralelos e um fio de borda antiparalela, rodeado por sete hélices α. O domínio contém dobra de ligação de nucleotídeo (nbf) na extremidade C-terminal da primeira fita β. O domínio PFK-2 parece estar intimamente relacionado com a superfamília de proteínas de ligação a mononucleotídeos, incluindo adenilato ciclase .
Por outro lado, o domínio da fosfatase está localizado no C-terminal. Assemelha-se à família de proteínas que incluem fosfoglicerato mutases e fosfatases ácidas. O domínio tem uma estrutura α / β mista, com uma folha β central de seis fitas, além de um subdomínio α-helicoidal adicional que cobre o sítio ativo presumido da molécula. Finalmente, a região N-terminal modula as atividades de PFK-2 e FBPase2 e estabiliza a forma de dímero da enzima.
Embora este núcleo catalítico central permaneça conservado em todas as formas de PFK-2, existem pequenas variações estruturais nas isoformas como resultado de diferentes sequências de aminoácidos ou splicing alternativo. Com algumas pequenas exceções, o tamanho das enzimas PFK-2 é normalmente em torno de 55 kDa.
Os pesquisadores levantam a hipótese de que a estrutura bifuncional única desta enzima surgiu de um evento de fusão gênica entre uma PFK-1 bacteriana primordial e uma mutase / fosfatase primordial.
Função
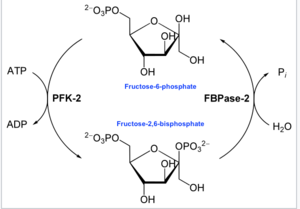
A principal função desta enzima é sintetizar ou degradar o regulador alostérico Fru-2,6-P 2 em resposta às necessidades glicolíticas da célula ou organismo, conforme ilustrado no diagrama a seguir.
Em enzimologia , uma 6-fosfofruto-2-quinase ( EC 2.7.1.105 ) é uma enzima que catalisa a reação química :
- ATP + beta-D-frutose 6-fosfato ADP + beta-D-frutose 2,6-bifosfato
Assim, o domínio de cinase hidrolisa ATP para fosforilar o carbono-2 da frutose-6-fosfato, produzindo Fru-2,6-P 2 e ADP . Um intermediário de fosfo-histidina é formado na reação.
- No outro terminal, a frutose-2,6-bisfosfato 2-fosfatase ( EC 3.1.3.46 ) de domínio desfosforila Fru-2,6-P 2 com a adição de água. Esta reação química oposta é:
- beta-D-frutose 2,6-bifosfato + H 2 O D-frutose 6-fosfato + fosfato
Por causa das funções duplas da enzima, ela pode ser categorizada em várias famílias. Por categorização pela reação de quinase, esta enzima pertence à família das transferases , especificamente aquelas que transferem grupos contendo fósforo ( fosfotransferases ) com um grupo álcool como aceitador. Por outro lado, a reação da fosfatase é característica da família das hidrolases , especificamente aquelas que atuam nas ligações do monoéster fosfórico .
Regulamento
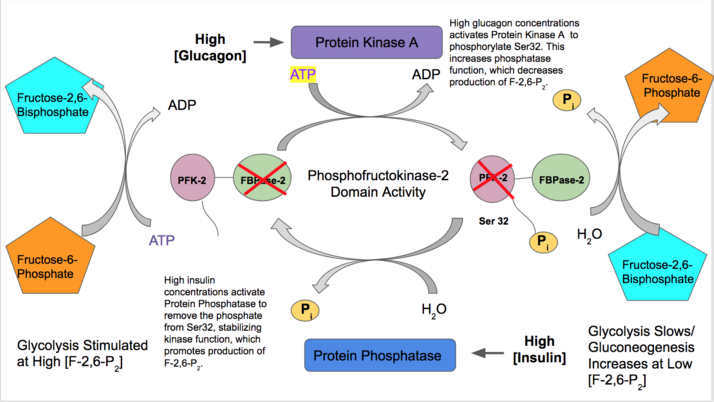
Em quase todas as isoformas, PFK-2 sofre modificação covalente por meio de fosforilação / desfosforilação com base na sinalização hormonal da célula. A fosforilação de um resíduo específico pode levar a uma mudança que estabiliza a função do domínio da quinase ou da fosfatase. Este sinal de regulação, portanto, controla se o F-2,6-P 2 será sintetizado ou degradado.
Além disso, a regulação alostérica de PFK2 é muito semelhante à regulação de PFK1 . Altos níveis de AMP ou grupo fosfato significam um estado de carga de baixa energia e, portanto, estimulam PFK2. Por outro lado, uma alta concentração de fosfoenolpiruvato (PEP) e citrato significa que há um alto nível de precursor biossintético e, portanto, inibe PFK2. Ao contrário de PFK1, PFK2 não é afetado pela concentração de ATP.
Isoenzimas
As isoenzimas proteicas são enzimas que catalisam a mesma reação, mas são codificadas com diferentes sequências de aminoácidos e, como tal, apresentam ligeiras diferenças nas características das proteínas. Em humanos, os quatro genes que codificam as proteínas fosfofrutocinase 2 incluem PFKFB-1 , PFKFB2 , PFKFB3 e PFKFB4 .
Múltiplas isoformas da proteína em mamíferos foram relatadas até o momento, a diferença aumentando tanto pela transcrição de diferentes enzimas quanto pelo splicing alternativo. Enquanto o núcleo estrutural que catalisa a reação PFK-2 / FBPase-2 é altamente conservado em isoformas, as principais diferenças surgem de sequências flanqueadoras altamente variáveis nos terminais amino e carboxila da isoforma. Como essas áreas geralmente contêm locais de fosforilação, as alterações na composição de aminoácidos ou no comprimento terminal podem resultar em cinéticas e características enzimáticas muito diferentes. Cada variante difere em seu tecido primário de expressão, resposta à regulação da proteína quinase e razão de atividade do domínio quinase / fosfatase. Embora vários tipos de isozimas possam consistir em um tecido, as isoenzimas são identificadas por sua expressão primária no tecido e tecido da descoberta abaixo.
PFKB1: Fígado, músculo e fetal
| 6-fosfofruto-2-quinase: PFKB1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estrutura cristalina do fígado humano 6-fosfofruto-2-quinase / frutose-2,6-bisfosfatase
| |||||||||
| Identificadores | |||||||||
| EC nº | 2.7.1.105 | ||||||||
| CAS no. | 78689-77-7 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
Localizado no cromossomo X, esse gene é o mais conhecido dos quatro genes, principalmente porque codifica a enzima hepática altamente pesquisada. O splicing de mRNA variável de PFKB1 produz três promotores diferentes (L, M e F) e, portanto, três variantes específicas de tecido que diferem na regulação:
- Tipo L: tecido do fígado
- A insulina ativa a função PFK-2 do fígado para indicar que uma grande abundância de glicose no sangue está disponível para a glicólise. A insulina ativa uma proteína fosfatase que desfosforila o complexo PFK-2 e causa atividade PFK-2 favorecida. O PFK-2 então aumenta a produção de F-2,6-P 2. Como este produto ativa alostericamente o PFK-1, ele ativa a glicólise e inibe a gliconeogênese.
- Em contraste, o glucagon aumenta a atividade da FBPase-2. Em baixas concentrações de glicose no sangue, o glucagon dispara uma cascata de sinal de cAMP e, por sua vez, a proteína quinase A (PKA) fosforila a serina 32 próximo ao N-terminal. Isso inativa a capacidade da enzima bifuncional de agir como uma quinase e estabiliza a atividade da fosfatase. Portanto, o glucagon diminui as concentrações de F-2,6-P 2, diminui as taxas de glicólise e estimula a via da gliconeogênese.
- Tipo M: tecido muscular esquelético; Tipo F: fibroblasto e tecido fetal
- Em contraste com a maioria dos outros tecidos PFK-2, PFK-2 tanto no músculo esquelético quanto no tecido fetal é apenas regulado por concentrações de Frutose-6-fosfato. Dentro de seu primeiro exon, não há sítios regulatórios que requerem fosforilação / desfosforilação para provocar uma mudança na função. Altas concentrações de F-6-P irão ativar a função quinase e aumentar as taxas de glicólise, enquanto baixas concentrações de F-6-P irão estabilizar a ação da fosfatase.
| 6-fosfofruto-2-quinase: PFKB2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dímero de 6-fosfofruto-2-quinase, tecido cardíaco humano
| |||||||||
| Identificadores | |||||||||
| EC nº | 2.7.1.105 | ||||||||
| CAS no. | 78689-77-7 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
PFKB2: Cardíaco (tipo H)
O gene PFKB2 está localizado no cromossomo 1. Quando maiores concentrações de adrenalina e / ou hormônio da insulina são circuladas, uma via da proteína quinase A é ativada, a qual fosforila a Serina 466 ou a Serina 483 no terminal C. Alternativamente, a proteína quinase B também pode fosforilar esses locais reguladores, que fazem parte do domínio FBPase-2. Quando este resíduo de serina é fosforilado, a função da FBPase-2 é inativada e a maior atividade da PFK-2 é estabilizada.
PFKB3: cérebro, placenta e induzível
PFKB3 está localizado no cromossomo 10 e transcreve duas isoformas principais, tipo induzível e tipo ubíquo. Essas formas diferem no splicing alternativo do Exon 15 em seu terminal C. No entanto, eles são semelhantes porque, para ambos, o glucagon ativa uma via do AMP cíclico; isto resulta na proteína quinase A, proteína quinase C ou proteína quinase ativada por AMP fosforilando um resíduo regulador na Serina 461 no terminal C para estabilizar a função da PFK-2 quinase. Além disso, ambas as isoformas transcritas a partir deste gene são notadas por terem uma taxa dominante particularmente alta de atividade quinase, conforme indicado por uma relação de atividade quinase / fosfatase de 700 (enquanto as isoenzimas de fígado, coração e testículo, respectivamente, têm PFK-2 / FBPase- 2 proporções de 1,5, 80 e 4). Portanto, o PFKB3 em particular produz consistentemente grandes quantidades de F-2,6-P 2 e mantém altas taxas de glicólise.
- Tipo I: indutível
- O nome desta isoforma é o resultado de sua expressão aumentada em resposta ao estresse hipóxico; sua formação é induzida pela falta de oxigênio. Este tipo é altamente expresso em células de proliferação rápida, especialmente células tumorais.
- Tipo U: Ubíquo; também conhecido como placentário ou cérebro
- Embora descobertas separadamente na placenta, na ilhota β pancreática ou nos tecidos cerebrais, as várias isoformas parecem idênticas. Os tecidos em que foi descoberto requerem grande energia para funcionar, o que pode explicar a vantagem do PFKB3 dessa alta relação de atividade quinase-fosfatase.
- A isoforma do cérebro, em particular, tem regiões terminais N e C extensas, de modo que esse tipo é quase duas vezes maior que o PFK-2 típico, em torno de 110 kDa.
PFKB4: Testículos (tipo T)
O gene PFKB4, localizado no cromossomo 3, expressa PFK-2 em tecido de testículo humano. As enzimas PFK-2 codificadas por PFK-4 são comparáveis à enzima hepática em tamanho em torno de 54kDa e, como o tecido muscular, não contêm um local de fosforilação da proteína quinase. Embora menos pesquisas tenham esclarecido os mecanismos de regulação para esta isoforma, estudos confirmaram que a modificação de vários fatores de transcrição na região flanqueadora 5 'regula a quantidade de expressão de PFK-2 no tecido testicular em desenvolvimento. Esta isoforma tem sido particularmente implicada como sendo modificada e hiperexpressa para a sobrevivência das células do câncer de próstata.
Significado clínico
Por manter taxas de glicólise e gliconeogênese, essa família de enzimas apresenta grande potencial de ação terapêutica para controle do metabolismo principalmente em diabetes e células cancerosas. Os dados também demonstram que todos os genes PFK-2 (embora a resposta do gene PFKB3 permaneça a mais drástica) foram ativados por limitações de oxigênio. O controle da atividade de PFK-2 / FBP-ase2 foi encontrado para estar ligado ao funcionamento do coração, particularmente para isquemia , e o controle contra hipóxia . Os pesquisadores levantam a hipótese de que esta característica responsiva dos genes PFK-2 pode ser uma adaptação fisiológica evolutiva forte. No entanto, muitos tipos de células cancerosas humanas (incluindo leucemia, pulmão, mama, cólon, pâncreas e câncer de ovário) demonstram superexpressão de PFK3 e / ou PFK4; essa mudança no metabolismo provavelmente desempenha um papel no efeito Warburg .
Por último, o gene Pfkfb2 que codifica a proteína PFK2 / FBPase2 está ligado à predisposição à esquizofrenia .
Referências
- Van Schaftingen E, Hers HG (1981). "Fosfofrutocinase 2: a enzima que forma a frutose 2,6-bifosfato a partir da frutose 6-fosfato e ATP". Biochem. Biophys. Res. Comun . 101 (3): 1078–84. doi : 10.1016 / 0006-291X (81) 91859-3 . PMID 6458291 .
links externos
- Frutose + 2,6-bisfosfatase na Biblioteca Nacional de Medicina dos Estados Unidos Medical Subject Headings (MeSH)
- 6-fosfofrutocinase de Arabidopsis thaliana no genoma.jp
Este artigo incorpora texto de domínio público Pfam e InterPro IPR013079