Pirrolidina - Pyrrolidine
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Pirrolidina |
|||
| Outros nomes
Azolidina
Azaciclopentano Tetrahidropirrol Prolamina Azolano |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| 102395 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100,004,227 |
||
| Número EC | |||
| 1704 | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
| Número ONU | 1922 | ||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 4 H 9 N | |||
| Massa molar | 71,123 g · mol −1 | ||
| Aparência | Líquido límpido incolor | ||
| Densidade | 0,866 g / cm 3 | ||
| Ponto de fusão | −63 ° C (−81 ° F; 210 K) | ||
| Ponto de ebulição | 87 ° C (189 ° F; 360 K) | ||
| Miscível | |||
| Acidez (p K a ) | 11,27 (p K a de ácido conjugado em água), 19,56 (p K a de ácido conjugado em acetonitrila) |
||
| -54,8 · 10 −6 cm 3 / mol | |||
|
Índice de refração ( n D )
|
1,4402 a 28 ° C | ||
| Perigos | |||
| Riscos principais | altamente inflamável, prejudicial, corrosivo, possível mutagênico | ||
| Ficha de dados de segurança | MSDS | ||
| Pictogramas GHS |
  
|
||
| Palavra-sinal GHS | Perigo | ||
| H225 , H302 , H314 , H318 , H332 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P301 + 312 , P301 + 330 + 331 , P303 + 361 + 353 , P304 + 312 , P304 + 340 , P305 + 351 + 338 , P310 , P312 , P321 , P330 , P363 , P370 + 378 , P403 + 235 | |||
| NFPA 704 (diamante de fogo) | |||
| Ponto de inflamação | 3 ° C (37 ° F; 276 K) | ||
| 345 ° C (653 ° F; 618 K) | |||
| Compostos relacionados | |||
|
Compostos heterocíclicos de nitrogênio relacionados
|
Pirrol (aromático com duas ligações duplas) Pirrolina (uma ligação dupla) Pirrolizidina (dois anéis pentagonais) |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
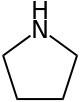
A pirrolidina , também conhecida como tetra-hidropirrol , é um composto orgânico com a fórmula molecular (CH 2 ) 4 NH. É uma amina secundária cíclica , também classificada como heterociclo saturado . É um líquido incolor que é miscível com água e a maioria dos solventes orgânicos. Tem um odor característico que foi descrito como "amoniacal, a peixe, semelhante a marisco". Além da própria pirrolidina, muitas pirrolidinas substituídas são conhecidas.
Produção e síntese
Produção industrial
A pirrolidina é preparada industrialmente pela reação de 1,4-butanodiol e amônia a uma temperatura de 165–200 ° C e uma pressão de 17–21 MPa na presença de um catalisador de óxido de cobalto e níquel , que é suportado em alumina .
A reação é realizada na fase líquida em um reator de tubo ou feixe de tubos contínuo, que é operado no método de gás de ciclo. O catalisador está disposto em leito fixo e a conversão é realizada no modo de fluxo descendente. O produto é obtido após purificação em múltiplos estágios e separação por destilação extrativa e azeotrópica .
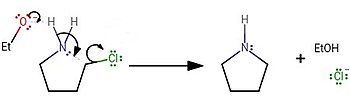
Síntese de Laboratório
No laboratório, a pirrolidina geralmente era sintetizada pelo tratamento de 4-clorobutan-1-amina com uma base forte:
Ocorrência
Muitas modificações da pirrolidina são encontradas na química natural e sintética. A estrutura do anel da pirrolidina está presente em vários alcalóides naturais , como a nicotina e a higrina . É encontrada em muitos medicamentos, como prociclidina e bepridil . Também forma a base para os compostos racetam ( por exemplo , piracetam , aniracetam ). Os aminoácidos prolina e hidroxiprolina são, em um sentido estrutural, derivados da pirrolidina.
Reações
A pirrolidina é uma base. Sua basicidade é típica de outras dialquilaminas. Em relação a muitas aminas secundárias, a pirrolidina é distinta por causa de sua compactação, uma consequência de sua estrutura cíclica.
A pirrolidina é usada como um bloco de construção na síntese de compostos orgânicos mais complexos. É usado para ativar cetonas e aldeídos em direção à adição nucleofílica pela formação de enaminas (por exemplo, usado na alquilação de enamina Stork ):
Referências
- ^ União internacional da química pura e aplicada (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 . The Royal Society of Chemistry . p. 142. doi : 10.1039 / 9781849733069 . ISBN 978-0-85404-182-4.
- ^ Hall, HK (1957). "Correlação das Forças Básicas de Aminas". Journal of the American Chemical Society . 79 (20): 5441–5444. doi : 10.1021 / ja01577a030 .
- ^ Kaljurand, I .; Kütt, A .; Sooväli, L .; Rodima, T .; Mäemets, V .; Leito, I .; Koppel, IA (2005). "Extensão da escala de basicidade espectrofotométrica autoconsistente em acetonitrila para um intervalo completo de unidades de 28 pKa: Unificação de diferentes escalas de basicidade". The Journal of Organic Chemistry . 70 (3): 1019–1028. doi : 10.1021 / jo048252w . PMID 15675863 .
- ^ Pirrolidina arquivada em 21-11-2017 na Wayback Machine , The Good Scents Company
- ^ a b Bou Chedid, Roland; Melder, Johann-Peter; Dostalek, romano; Pastre, Jörg; Tan, Aik Meam. "Processo para a preparação de pirrolidina" . Patentes do Google . BASF SE. Arquivado do original em 5 de julho de 2019 . Retirado em 5 de julho de 2019 .
- ^ HK Hall, Jr. (1957). "Correlação das Forças Básicas de Aminas". Geléia. Chem. Soc . 79 (20): 5441. doi : 10.1021 / ja01577a030 .
- ^ RB Woodward , IJ Pachter e ML Scheinbaum (1974). "2,2- (Trimetilenoditio) ciclohexanona" . Sínteses orgânicas . 54 : 39.CS1 maint: vários nomes: lista de autores ( link ); Volume coletivo , 6 , pág. 1014
links externos
-
 Mídia relacionada à pirrolidina no Wikimedia Commons
Mídia relacionada à pirrolidina no Wikimedia Commons