Salicilaldeído - Salicylaldehyde
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
2-hidroxibenzaldeído |
|||
| Outros nomes
Salicilaldeído Aldeído
salicílico o- Hidroxibenzaldeído |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| 471388 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100,001,783 |
||
| Número EC | |||
| 3273 | |||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 7 H 6 O 2 | |||
| Massa molar | 122,123 g · mol −1 | ||
| Densidade | 1,146 g / cm 3 | ||
| Ponto de fusão | -7 ° C (19 ° F; 266 K) | ||
| Ponto de ebulição | 196 a 197 ° C (385 a 387 ° F; 469 a 470 K) | ||
| -64,4 · 10 −6 cm 3 / mol | |||
| Perigos | |||
| Ficha de dados de segurança | |||
| Pictogramas GHS |
 
|
||
| Palavra-sinal GHS | Aviso | ||
| H302 , H315 , H317 , H319 , H335 , H411 | |||
| P280 , P305 + 351 + 338 | |||
| Compostos relacionados | |||
|
Compostos relacionados
|
Ácido salicílico Benzaldeído Salicilaldoxima |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O aldeído salicílico (2-hidroxibenzaldeído) é o composto orgânico com a fórmula C 6 H 4 CHO-2-OH. Junto com o 3-hidroxibenzaldeído e o 4-hidroxibenzaldeído , é um dos três isômeros do hidroxibenzaldeído . Este líquido oleoso incolor tem um odor de amêndoa amarga em concentração mais alta. O salicilaldeído é um precursor chave para uma variedade de agentes quelantes , alguns dos quais são comercialmente importantes.
Produção
O salicilaldeído é preparado a partir de fenol e clorofórmio por aquecimento com hidróxido de sódio ou hidróxido de potássio em uma reação de Reimer-Tiemann :
Alternativamente, é produzido por condensação de fenol ou seus derivados com formaldeído para dar álcool hidroxibenzílico, que é oxidado ao aldeído.
Os salicilaldeídos em geral podem ser preparados por outras reações de formilação orto-seletiva a partir do fenol correspondente, por exemplo pela reação de Duff , ou por tratamento com paraformaldeído na presença de cloreto de magnésio e uma base.
Ocorrências naturais
O salicilaldeído foi identificado como um componente de aroma característico do trigo sarraceno .
É também um dos componentes do castóreo , o exsudato das bolsas de mamona do castor norte-americano maduro ( Castor canadensis ) e do castor europeu ( fibra de mamona ), utilizado na perfumaria.
Além disso, o salicilaldeído ocorre nas secreções defensivas larvais de várias espécies de escaravelhos que pertencem à subtribo Chrysomelina. Um exemplo de uma espécie de besouro das folhas que produz salicilaldeído é o besouro das folhas do choupo vermelho Chrysomela populi .
Reações e aplicações
O salicilaldeído é usado para fazer o seguinte:
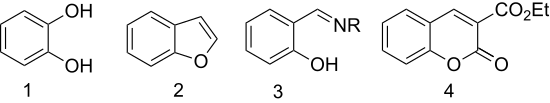
- A oxidação com peróxido de hidrogênio dá catecol (1,2-dihidroxibenzeno) ( reação de Dakin ).
- A eterificação com ácido cloroacético seguida de ciclização dá o heterociclo benzofurano (cumarona). {A primeira etapa nesta reação ao benzofurano substituído é chamada de condensação Rap-Stoermer após E. Rap (1895) e R. Stoermer (1900).
- O salicilaldeído é convertido em ligantes quelantes por condensação com aminas. Com a etilenodiamina , ele se condensa para dar salen ao ligante . A hidroxilamina dá salicilaldoxima .
- A condensação com malonato dietílico dá 3-carbetoxicumarina (um derivado da cumarina ) por condensação aldólica .