Succinil coenzima A sintetase - Succinyl coenzyme A synthetase
| Succinato-CoA ligase (formadora de GDP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Succinil-CoA sintetase específica de GTP de porco com GTP. PDB 2fp4
| |||||||||
| Identificadores | |||||||||
| Número CE | 6.2.1.4 | ||||||||
| Número CAS | 9014-36-2 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Gene Ontology | AmiGO / QuickGO | ||||||||
| |||||||||
| Succinato - CoA ligase (formadora de ADP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Succinil-COA sintetase de Escherichia coli . PDB 2scu
| |||||||||
| Identificadores | |||||||||
| Número CE | 6.2.1.5 | ||||||||
| Número CAS | 9080-33-5 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Gene Ontology | AmiGO / QuickGO | ||||||||
| |||||||||
Succinil coenzima A sintetase ( SCS , também conhecido como succinil-CoA sintetase ou succinato tioquinase ou succinato-CoA ligase ) é uma enzima que catalisa a reação reversível de succinil-CoA em succinato . A enzima facilita o acoplamento dessa reação à formação de uma molécula de trifosfato de nucleosídeo (tanto GTP quanto ATP ) a partir de uma molécula de fosfato inorgânico e uma molécula de difosfato de nucleosídeo (ou GDP ou ADP ). Ele desempenha um papel fundamental como um dos catalisadores envolvidos no ciclo do ácido cítrico , uma via central no metabolismo celular , e está localizado dentro da matriz mitocondrial de uma célula.
Reação química e mecanismo enzimático
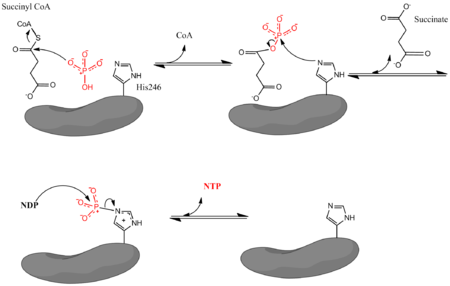
A succinil CoA sintetase catalisa a seguinte reação reversível :
- Succinil CoA + Pi + NDP ↔ Succinato + CoA + NTP
onde Pi denota fosfato inorgânico, NDP denota difosfato de nucleosídeo (ou GDP ou ADP) e NTP denota trifosfato de nucleosídeo (GTP ou ATP). Como mencionado, a enzima facilita o acoplamento da conversão de succinil CoA em succinato com a formação de NTP a partir de NDP e Pi. A reação tem uma mudança de energia livre de estado de padrão bioquímico de -3,4 kJ / mol. A reação ocorre por um mecanismo de três etapas que é ilustrado na imagem abaixo. A primeira etapa envolve o deslocamento de CoA de succinil CoA por uma molécula de fosfato inorgânico nucleofílico para formar succinil fosfato. A enzima então utiliza um resíduo de histidina para remover o grupo fosfato do fosfato de succinila e gerar succinato. Finalmente, a histidina fosforilada transfere o grupo fosfato para um difosfato de nucleosídeo, que gera o trifosfato de nucleosídeo portador de alta energia.
Estrutura
Subunidades
As SCSs bacterianas e de mamíferos são constituídas por subunidades α e β . Em E. coli, dois heterodímeros αβ ligam-se para formar uma estrutura heterotetramérica α 2 β 2 . No entanto, os SCSs mitocondriais de mamíferos são ativos como dímeros αβ e não formam um heterotetrâmero. O heterotetrâmero de E. coli SCS foi cristalizado e caracterizado em grande detalhe. Como pode ser visto na Imagem 2, as duas subunidades α (rosa e verde) residem em lados opostos da estrutura e as duas subunidades β (amarela e azul) interagem na região do meio da proteína. As duas subunidades α interagem apenas com uma única unidade β, enquanto as unidades β interagem com uma única unidade α (para formar o dímero αβ) e a subunidade β do outro dímero αβ. Uma curta cadeia de aminoácidos liga as duas subunidades β que dá origem à estrutura tetramérica.
A estrutura de cristal de succinil-CoA-sintetase foi determinada por Joyce et ai subunidade alfa (isoforma succinil-CoA-ligação). para uma resolução de 2.10 A, com PDB código 1CQJ. [1] .
Resíduos catalíticos
As estruturas cristalinas para as de E. coli SCS fornecem evidências de que os coenzima A liga-se dentro de cada α-subunidade (dentro de um Rossmann vezes ) em estreita proximidade com um resíduo de histidina (His246α). Este resíduo de histidina torna-se fosforilado durante a etapa de formação de succinato no mecanismo de reação. A localização exata de ligação de succinato não está bem definido. A formação do trifosfato de nucleósido ocorre num domínio de ATP aperto, o qual está localizado perto da extremidade N-terminal da subunidade cada β. No entanto, este domínio de compreensão está localizado a cerca de 35 Å de distância do resíduo de histidina fosforilado. Isto conduz aos investigadores acreditam que a enzima deve ser submetida a uma grande mudança na conformação para trazer a histidina para o domínio de aperto e facilitar a formação do nucleósido-trifosfato. Mutagénese experiências têm determinado que dois glutamato resíduos (uma perto da histidina catalítica, Glu208α e um perto do domínio de ATP aperto, Glu197β) desempenham um papel na fosforilação e desfosforilação da histidina, mas o mecanismo exacto pelo qual a enzima altera a conformação não está totalmente compreendido.
Isoformas
Johnson et al. descrevem duas isoformas de succinil-CoA sintetase em mamíferos , uma que especifica a síntese de ADP e outra que sintetiza GDP .
- EC 6.2.1.5 - Formador de ADP - SUCLA2
- EC 6.2.1.4 - Formação de PIB - SUCLG1 , SUCLG2
Em mamíferos, a enzima é um heterodímero de uma subunidade α e β. A especificidade para os fosfatos de adenosina ou guanosina é definida pela subunidade β, que é codificada por 2 genes. SUCLG2 é específico para GTP e SUCLA2 é específico para ATP, enquanto SUCLG1 codifica a subunidade α comum. As variantes β são produzidas em diferentes quantidades em diferentes tecidos, causando GTP ou requisitos de substrato ATP .
Os tecidos que mais consomem, como o coração e o cérebro, têm mais succinil-CoA sintetase específica para ATP (ATPSCS), enquanto os tecidos sintéticos, como rim e fígado, têm a forma mais específica para GTP (GTPSCS). A análise cinética de ATPSCS do músculo do peito de pombos e GTPSCS do fígado de pombo mostrou que suas constantes aparentes de Michaelis eram semelhantes para CoA, mas diferentes para os nucleotídeos, fosfato e succinato. A maior diferença foi para o succinato: Km app de ATPSCS = 5mM versus GTPSCS = 0,5mM.
Função
Geração de trifosfatos de nucleosídeo
SCS é a única enzima no ciclo do ácido cítrico que catalisa uma reação na qual um trifosfato de nucleosídeo (GTP ou ATP) é formado por fosforilação em nível de substrato . Estudos de pesquisa demonstraram que os SCSs de E. coli podem catalisar a formação de GTP ou ATP. No entanto, os mamíferos possuem diferentes tipos de SCSs que são específicos para GTP (G-SCS) ou ATP (A-SCS) e são nativos para diferentes tipos de tecido dentro do organismo. Um estudo interessante usando células de pombo mostrou que SCSs específicos de GTP estavam localizados nas células do fígado de pombos e SCSs específicos de ATP estavam localizados nas células do músculo do peito de pombos. Outras pesquisas revelaram um fenômeno semelhante de SCSs específicos de GTP e ATP em ratos, camundongos e tecidos humanos. Parece que o tecido tipicamente envolvido no metabolismo anabólico (como o fígado e os rins) expressa G-SCS, enquanto o tecido envolvido no metabolismo catabólico (como o cérebro, o coração e o tecido muscular) expressa A-SCS.
Formação de intermediários metabólicos
SCS facilita o fluxo de moléculas em outras vias metabólicas, controlando a interconversão entre succinil CoA e succinato. Isso é importante porque o succinil CoA é um intermediário necessário para a biossíntese de porfirina , heme e corpos cetônicos .
Regulação e inibição
Em algumas bactérias, a enzima é regulada no nível transcricional. Foi demonstrado que o gene para SCS (sucCD) é transcrito junto com o gene para α-cetoglutarato desidrogenase (sucAB) sob o controle de um promotor denominado sdhC, que faz parte do operon succinato desidrogenase . Este operon é regulado positivamente pela presença de oxigênio e responde a uma variedade de fontes de carbono. Drogas antibacterianas que previnem a fosforilação da histidina, como a molécula LY26650, são inibidores potentes de SCSs bacterianos.
Atividade ótima
As medições (realizadas usando um SCS de soja) indicam uma temperatura ótima de 37 ° C e um pH ótimo de 7,0-8,0.
Papel na doença
Acidose láctica infantil fatal: o SCS defeituoso foi apontado como causa de acidose láctica infantil fatal , que é uma doença em bebês caracterizada pelo aumento de níveis tóxicos de ácido láctico. A condição (quando é mais grave) resulta em morte geralmente dentro de 2 a 4 dias após o nascimento. Foi determinado que os pacientes com a condição apresentam uma deleção de dois pares de bases no gene conhecido como SUCLG1 que codifica a subunidade α de SCS. Como resultado, o SCS funcional está ausente no metabolismo, causando um grande desequilíbrio no fluxo entre a glicólise e o ciclo do ácido cítrico. Como as células não têm um ciclo de ácido cítrico funcional, ocorre acidose porque as células são forçadas a escolher a produção de ácido lático como o meio primário de produção de ATP.
Veja também
- Ciclo do ácido cítrico
- Succinato desidrogenase
- Succinato - CoA ligase (formadora de ADP)
- Succinato-CoA ligase (formadora de GDP)
Referências
links externos
- Succinil + Coenzima + A + Sintetases na Biblioteca Nacional de Medicina dos EUA. Cabeçalhos de assuntos médicos (MeSH)