Acetato de cálcio - Calcium acetate
|
|
 Cristais de acetato de cálcio
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
Diacetato de cálcio |
|
| Outros nomes
Acetato de cal e
etanoato de cálcio |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| Abreviações | Ca (OAc) 2 |
| 3692527 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard |
100.000.492 |
| Número EC | |
| Número E | E263 (conservantes) |
| 22320 | |
| KEGG | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 4 H 6 Ca O 4 | |
| Massa molar | 158,166 g · mol −1 |
| Aparência | Sólido branco higroscópico |
| Odor | leve odor de ácido acético |
| Densidade | 1,509 g / cm 3 |
| Ponto de fusão | 160 ° C (320 ° F; 433 K) decomposição em CaCO 3 + acetona |
| 37,4 g / 100 mL (0 ° C) 34,7 g / 100 mL (20 ° C) 29,7 g / 100 mL (100 ° C) |
|
| Solubilidade | ligeiramente solúvel em metanol , hidrazina insolúvel em acetona , etanol e benzeno |
| Acidez (p K a ) | ca. 0,7 |
| -70,7 · 10 −6 cm 3 / mol | |
|
Índice de refração ( n D )
|
1,55 |
| Farmacologia | |
| V03AE07 ( OMS ) | |
| Perigos | |
| NFPA 704 (diamante de fogo) | |
| 680 a 730 ° C (1.256 a 1.346 ° F; 953 a 1.003 K) | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
4280 mg / kg (oral, rato) |
| Compostos relacionados | |
|
Outros cátions
|
Acetato de magnésio |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
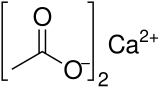
O acetato de cálcio é um composto químico que é um sal de cálcio do ácido acético . Tem a fórmula Ca (C 2 H 3 O 2 ) 2 . Seu nome padrão é acetato de cálcio, enquanto etanoato de cálcio é o nome sistemático. Um nome mais antigo é acetato de lima . A forma anidra é muito higroscópica ; portanto, o monohidrato (Ca (CH 3 COO) 2 • H 2 O) é a forma comum.
Produção
O acetato de cálcio pode ser preparado embebendo carbonato de cálcio (encontrado em cascas de ovo, ou em rochas carbonáticas comuns, como calcário ou mármore ) ou cal hidratada em vinagre :
- CaCO 3 (s) + 2CH 3 COOH (aq) → Ca (CH 3 COO) 2 (aq) + H 2 O (l) + CO 2 (g)
- Ca (OH) 2 (s) + 2CH 3 COOH (aq) → Ca (CH 3 COO) 2 (aq) + 2H 2 O (l)
Uma vez que ambos os reagentes estariam disponíveis pré-historicamente, o produto químico seria observável como cristais então.
Usos
- Na doença renal , os níveis sanguíneos de fosfato podem aumentar (denominado hiperfosfatemia ), levando a problemas ósseos. O acetato de cálcio liga o fosfato na dieta para reduzir os níveis de fosfato no sangue.
- O acetato de cálcio é utilizado como aditivo alimentar , como estabilizador, tampão e sequestrante , principalmente em doces sob o número E263.
- O tofu é tradicionalmente obtido pela coagulação do leite de soja com sulfato de cálcio . O acetato de cálcio é uma alternativa melhor; sendo solúvel, requer menos habilidade e uma quantidade menor.
- Por ser barato, o acetato de cálcio já foi um material de partida comum para a síntese de acetona antes do desenvolvimento do processo de cumeno :
- Ca (CH 3 COO) 2 → CaCO 3 (s) + (CH 3 ) 2 CO
- Uma solução saturada de acetato de cálcio em álcool forma um gel semissólido e inflamável, muito parecido com produtos de "calor enlatado", como o Sterno . Professores de química costumam preparar "California Snowballs", uma mistura de solução de acetato de cálcio e etanol . O gel resultante é de cor esbranquiçada e pode ter a forma de uma bola de neve .
Ocorrência natural
O acetato de Ca puro ainda é desconhecido entre os minerais. Calclacita - cloreto de acetato de cálcio pentahidratado - é listado como um mineral conhecido, mas sua gênese é provavelmente antropogênica e pode em breve ser desacreditada.
Referências
- ^ União internacional da química pura e aplicada (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 . The Royal Society of Chemistry . p. 801. doi : 10.1039 / 9781849733069 . ISBN 978-0-85404-182-4.
- ^ Dale L. Perry (19 de maio de 2011). Handbook of Inorganic Compounds (Segunda ed.). Taylor e Francis. p. 84. ISBN 978-1-4398-1461-1.
- ^ "Acetato de cálcio" . Mayo Clinic . Página visitada em 19 de novembro de 2019 .
- ^ JY Lu, Eloise Carter e RA Chung (1980): "Use of Calcium Salts for Soybean Curd Preparation" Journal of Food Science , volume 45, edição 1, páginas 32-34 doi : 10.1111 / j.1365-2621.1980.tb03864. x
- ^ Leo Frank Goodwin; Edward Tyghe Sterne (1920). "Perdas incorridas na preparação da acetona pela destilação do acetato de cal" . Química Industrial e de Engenharia . 12 (3): 240–243. doi : 10.1021 / ie50123a012 .
- ^ EGR Ardagh; AD Barbour; GE McClellan; EW McBride (1924). "Destilação de acetato de cal". Química Industrial e de Engenharia . 16 (11): 1133–1139. doi : 10.1021 / ie50179a013 .
- ^ "Canned Heat" no Journal of Chemical Education "Chemistry comes alive!"
- ^ Recursos de ensino de química
- ^ "Calclacite" .
- ^ "Lista de minerais" . 21 de março de 2011.

