Diidroxilação - Dihydroxylation
Diidroxilação é o processo pelo qual um alceno é convertido em um diol vicinal . Embora existam muitas rotas para realizar essa oxidação , os processos mais comuns e diretos usam um metal de transição de alto estado de oxidação (normalmente ósmio ou manganês). O metal é freqüentemente usado como um catalisador , com algum outro oxidante estequiométrico presente. Além disso, outros metais de transição e métodos de metais não de transição foram desenvolvidos e usados para catalisar a reação.
Mecanismo
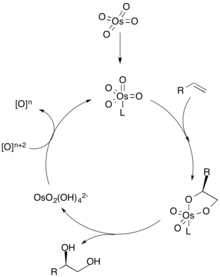
No mecanismo de diidroxilação, um ligante primeiro se coordena com o catalisador de metal (representado como ósmio), o que dita a seletividade quiral da olefina. O alceno então se coordena com o metal por meio de uma cicloadição [3 + 2], e o ligante se dissocia do catalisador metálico. A hidrólise da olefina então produz o diol vicinal e a oxidação do catalisador por um oxidante estequiométrico regenera o catalisador de metal para repetir o ciclo. A concentração da olefina é crucial para o excesso enantiomérico do diol, uma vez que concentrações mais elevadas do alceno podem se associar ao outro sítio catalítico para produzir o outro enantiômero.
Reações catalisadas por ósmio
O tetróxido de ósmio (OsO 4 ) é um oxidante popular usado na diidroxilação de alcenos devido à sua confiabilidade e eficiência na produção de sin-dióis. Por ser caro e tóxico, quantidades catalíticas de OsO 4 são usadas em conjunto com um agente oxidante estequiométrico. As reações de hidroxilação Milas , diidroxilação Upjohn e diidroxilação assimétrica de Sharpless usam ósmio como catalisador, bem como vários agentes oxidantes secundários.
Milas
A diidroxilação Milas foi introduzida em 1930 e usa peróxido de hidrogênio como agente oxidante estequiométrico. Embora o método possa produzir dióis, a superoxidação para o composto dicarbonil levou a dificuldades de isolamento do diol vicinal. Portanto, o protocolo Milas foi substituído pela diidroxilação assimétrica Upjohn e Sharpless.
Upjohn
A diidroxilação Upjohn foi relatada em 1973 e usa OsO 4 como o catalisador ativo no procedimento de diidroxilação. Ele também emprega N-óxido de N-metilmorfolina (NMO) como o oxidante estequiométrico para regenerar o catalisador de ósmio, permitindo que quantidades catalíticas de ósmio sejam usadas. O protocolo Upjohn produz altas conversões para o diol vicinal e tolera muitos substratos. No entanto, o protocolo não pode dihidroxilar alcenos tetrassubstituídos. As condições Upjohn podem ser usadas para sintetizar anti-dióis de álcoois alílicos, conforme demonstrado por Kishi e colaboradores.
Sharpless assimétrico
A diidroxilação assimétrica de Sharpless foi desenvolvida por K. Barry Sharpless para usar quantidades catalíticas de OsO 4 junto com o oxidante estequiométrico K 3 [Fe (CN) 6 ]. A reação é realizada na presença de um auxiliar quiral. A seleção da diidroquinidina (DHQD) ou diidroquinina (DHQ) como auxiliar quiral dita a seletividade facial da olefina, uma vez que as configurações absolutas dos ligantes são opostas. O catalisador, o oxidante e o auxiliar quiral podem ser adquiridos pré-misturados para dihidroxilação seletiva. AD-mix-α contém o auxiliar quiral (DHQ) 2 PHAL, que posiciona OsO 4 na face alfa da olefina; AD-mix-β contém (DHQD) 2 PHAL e distribui grupos hidroxila para a face beta. A diidroxilação assimétrica Sharpless tem um grande escopo para seletividade de substrato, alterando a classe quiral auxiliar.
Outras variantes
Como mencionado acima, a capacidade de sintetizar anti-dióis a partir de álcoois alílicos pode ser alcançada com o uso de NMO como um oxidante estequiométrico. O uso de tetrametilenodiamina (TMEDA) como ligante produziu sin-dióis com uma proporção diastereomérica favorável em comparação ao protocolo de Kishi; no entanto, o ósmio estequiométrico é empregado. A seletividade Syn é devida à capacidade doadora de ligações de hidrogênio do álcool alílico e à capacidade aceitadora da diamina. Desde então, isso foi aplicado a sistemas homoalílicos.
Outros métodos de diidroxilação
Como o tetróxido de ósmio é caro e tóxico, outros metais têm sido usados para preparar dióis vicinais a partir de olefinas. Outro metal popular usado na diidroxilação é o rutênio. Embora seja altamente oxidativo, o rutênio tem sido utilizado devido ao seu curto tempo de reação e ao seu custo-benefício. Normalmente, o tetróxido de rutênio é criado in situ a partir do tricloreto de rutênio e um oxidante secundário NaIO 4 é usado para regenerar o catalisador. A etapa limitante do turnover da reação é a etapa de hidrólise; portanto, ácido sulfúrico é adicionado para aumentar a taxa desta etapa.
O manganês também é usado na diidroxilação e geralmente é escolhido quando os métodos de tetróxido de ósmio apresentam resultados ruins. Semelhante ao rutênio, o potencial de oxidação do manganês é alto, levando à oxidação excessiva dos substratos. O permanganato de potássio é freqüentemente usado como o oxidante para a di-hidroxilação; no entanto, devido à sua baixa solubilidade em solvente orgânico, um catalisador de transferência de fase (como cloreto de benziltrietilamônio, TEBACl) também é adicionado para aumentar o número de substratos para diidroxilação.
Diidroxilação Prévost e Woodward
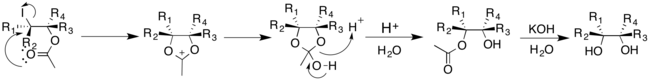
Ao contrário dos outros métodos descritos que usam metais de transição como catalisador, os métodos Prévost e Woodward usam iodo e um sal de prata. No entanto, a adição de água na reação direciona a adição cis e trans dos grupos hidroxila. A reação Prévost normalmente usa benzoato de prata para produzir trans-dióis; a modificação Woodward da reação Prévost usa acetato de prata para produzir cis-dióis. Em ambas as reações Prévost e Woodward, o iodo é adicionado primeiro ao alceno produzindo um íon de iodínio cíclico. O ânion do sal de prata correspondente é então adicionado por substituição nucleofílica ao íon iodínio.
Na reação Prévost, o íon iodínio sofre ataque nucleofílico pelo ânion benzoato. O ânion benzoato atua como um nucleófilo novamente para deslocar o iodeto por meio de um mecanismo de participação de um grupo vizinho. Um segundo ânion benzoato reage com o intermediário para produzir o produto dibenzoato anti-substituído, que pode então sofrer hidrólise para produzir trans-dióis.
A modificação de Woodward da reação Prévost produz cis-dióis. O ânion acetato reage com o íon iodínio cíclico para produzir um intermediário do íon oxônio. Isso pode então reagir prontamente com água para dar o monoacetato, que pode então ser hidrolisado para dar um cis-diol
Para eliminar a necessidade de sais de prata, Sudalai e colegas de trabalho modificaram a reação Prévost-Woodward; a reação é catalisada com LiBr e usa NaIO 4 e PhI (OAc) 2 como oxidantes. LiBr reage com NaIO 4 e ácido acético para produzir acetato de lítio, que pode então prosseguir através da reação conforme mencionado anteriormente. O protocolo produziu alto dr para o diol correspondente, dependendo do oxidante escolhido.
Formulários
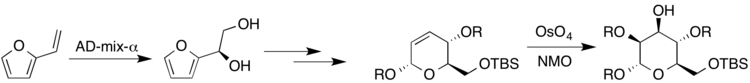
A síntese de açúcares altamente substituídos e estereoespecíficos é importante uma vez que os polissacarídeos constituem uma grande classe de compostos encontrados na natureza. Um exemplo específico é a molécula biologicamente ativa kakelokelose, que demonstrou ter atividade anti-HIV. Pesquisa conduzida por Harris et al. trabalharam em uma síntese enantioespecífica de açúcares pertencentes à kakelokelose e outros açúcares, empregando muitas reações de diidroxilação diferentes com catalisador de ósmio. Vinilfurano foi reagido sob condições de Sharpless com AD-mix-α para produzir (R) -diol. Mais tarde, um di-hidropirano resultante foi reagido sob condições Upjohn para produzir o açúcar resultante, manose (em que R representa H ou um grupo protetor).
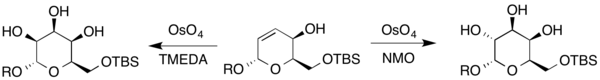
Além disso, talose e gulose também foram sintetizados a partir de um dihidropirano diferente. Uma vez que o composto contém um álcool alílico, as condições Upjohn e a modificação Upjohn usando TMEDA como oxidante secundário para criar os açúcares resultantes (onde R representa H ou um grupo protetor).
Outra aplicação dos métodos de diidroxilação é na síntese de esteróides. Brassinosteroides são uma classe de esteróides que regulam o crescimento das plantas e têm atividade agrícola como inseticida. Esta classe de esteróides contém a estrutura padrão de esteróides, além de quatro dióis vicinais que têm sua própria estereoquímica. Brosa instalou os grupos hidroxila no esteróide usando ambas as condições de Woodward para produzir um cis-diol para o anel A do esteróide. Em seguida, a cadeia alceno no anel D foi di-hidroxilada para produzir o segundo cis-diol usando OsO 4 e NMO como o oxidante estequiométrico.