Reação de Hajos – Parrish – Eder – Sauer – Wiechert - Hajos–Parrish–Eder–Sauer–Wiechert reaction
A reação Hajos – Parrish – Eder – Sauer – Wiechert em química orgânica é uma reação aldólica assimétrica catalisada por prolina . A reação leva o nome de seus principais investigadores, Zoltan Hajos outros, da Hoffmann-La Roche e Schering AG . Descoberto na década de 1970, o procedimento catalítico original de Hajos-Parrish - mostrado na equação de reação, levando ao cetol bicíclico opticamente ativo - pavimentou o caminho da organocatálise assimétrica . A modificação Eder-Sauer-Wiechert leva diretamente à enediona opticamente ativa, através da perda de água do cetol bicíclico mostrado na figura.
Tem sido usado extensivamente como uma ferramenta na síntese de esteróides e outras moléculas enantiomericamente puras.
Na reação original mostrada na figura acima, a prolina quiral que ocorre naturalmente é o catalisador quiral em uma reação Aldol . O material de partida é uma tricetona aquiral e requer apenas 3% de prolina para obter o produto da reação, um cetol em excesso enantiomérico de 93% . Como mostrado acima, Hajos e Parrish trabalharam à temperatura ambiente em solvente dimetilformamida (DMF) usando uma quantidade catalítica (3% equiv. Molar) de (S) - (-) - prolina, permitindo-lhes isolar o cetol bicíclico intermediário opticamente ativo. Assim, eles descreveram o primeiro uso de prolina em uma reação aldólica assimétrica catalítica.
História
As pesquisas sobre a catálise assimétrica da enamina aplicada a intermediários importantes na síntese de esteróides devem-se ao aumento do interesse por sínteses totais de esteróides eficientes e convenientes na década de 1960. Em particular, dois grupos industriais no início dos anos 1970 relataram reações aldólicas intramoleculares catalisadas por prolina.
Em 1971, o grupo Schering liderado por Escher trabalhou em condições não biológicas usando (S) -Prolina (47% molar), ácido perclórico 1 N , em acetonitrila a 80 ° C. Portanto, eles não puderam isolar o cetol bicíclico intermediário de Hajos-Parrish, mas, em vez disso, o produto de condensação (S) -7a-metil-2,3,7,7a-tetrahidro-1H-indeno-1,5 (6H) -diona através do perda de água. Trinta e sete anos depois, um novo grupo da Schering AG publicou a continuação do trabalho anterior da Schering. Em vez das condições não biológicas acima mencionadas, o novo grupo usou o procedimento catalítico de Hajos-Parrish. Assim, eles puderam isolar o cetol 6,5-bicíclico opticamente ativo descrito até agora apenas nas publicações Hajos-Parrish.
Em 1974, Hajos e Parrish publicaram a síntese de intermediários cetol bicíclicos com bom rendimento e excesso enantiomérico.
Eles investigaram ainda a configuração exata do cis-fundido-7a-metil-6,5-bicíclico-cetol mostrado no esquema de reação acima por dicroísmo circular , e esses resultados foram confirmados por um estudo de difração de raios-X de cristal único. O cristal centrosimétrico do cetol racêmico correspondente sem um marcador de átomo pesado foi obtido pelo uso de prolina racêmica. Ele mostrou por difração de raios-X uma orientação axial do grupo angular metila e uma orientação equatorial do grupo hidroxila no conformador de cadeira do anel de seis membros. Isso está de acordo com a estrutura cristalina do anel CD da digitoxigenina . A estrutura deste cetol e seu homólogo de etil são mostrados como segue:
Estudos semelhantes do 7a-etil-homólogo mostraram que o etil bicíclico cetol existia em uma conformação cis em que o grupo 7a-etil é orientado equatorialmente e o grupo hidroxil é axialmente orientado na forma de cadeira do anel de seis membros, como mostrado acima . A razão para uma preferência por esta conformação poderia ser a interação 1,3-diaxial aumentada no outro conformador cis entre o grupo etil angular e os hidrogênios axiais em C-4 e C-6 no anel de seis membros.
Versões intermoleculares
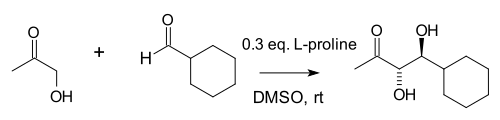
Em um estudo de 2000, o grupo Barbas descobriu que as adições de aldol intermolecular (aquelas entre cetonas e aldeídos) também são possíveis, embora com o uso de consideravelmente mais prolina:
Os autores observaram a semelhança da prolina, dos anticorpos de aldolase que eles criaram e das enzimas aldolase naturais aldolase A, todas operando por meio de um intermediário de enamina . Nesta reação, a grande concentração de acetona (um dos dois reagentes) suprime várias reações colaterais possíveis: reação da cetona com prolina para uma oxazolidinona e reação do aldeído com prolina para um ileto de azometina .
Notz e List expandiram a utilidade desta reação para a síntese de 1,2-dióis:
Em seu relato completo da Comunicação de 2000, o grupo revelou que a prolina juntamente com o sal de tiazólio 5,5-dimetil tiazolidínio-4-carboxilato foram considerados os catalisadores mais eficazes entre um grande grupo de aminas, enquanto a catálise com (S) Os sais de -1- (2-pirrolidinilmetil) -pirrolidina formaram a base para o desenvolvimento de organocatalisadores de diamina que se mostraram eficazes em uma ampla variedade de reações organocatalíticas.
A síntese assimétrica da cetona Wieland-Miescher (1985) é outra reação intramolecular também baseada na prolina, que foi explorada pelo grupo Barbas em 2000. Neste estudo o grupo Barbas demonstrou pela primeira vez que a prolina pode catalisar a cascata Michael- reação aldólica através da catálise combinada de imínio-enamina. Este trabalho é significativo porque apesar da história de 30 anos e da aplicação da reação Hajos-Parrish na indústria, o substrato da tricetona para essa reação sempre foi sintetizado em uma etapa independente e discreta, demonstrando que havia uma falta fundamental de compreensão do produto químico. mecanismo desta reação. O grupo Barbas relatou a anulação de imínio-enamina Robinson catalisada por anticorpos aldolase em seu estudo de 1997, que marcou o início de seus estudos na área agora chamada de organocatálise. Em um relatório publicado em 2002, Carlos F. Barbas III disse: "Trabalho na década de 1970 em reações de adição de aldol intramolecular catalisadas por prolina por químicos orgânicos sintéticos Zoltan G. Hajos e David R. Parrish do departamento de pesquisa química em Hoffmann-La Roche, Nutley, NJ, nos inspirou a olhar mais de perto os paralelos entre catalisadores de pequenas moléculas e enzimas ".
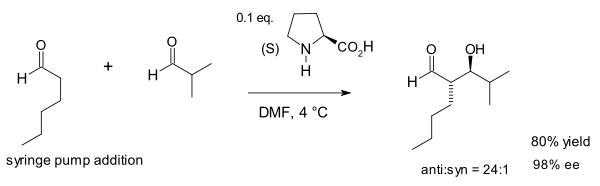
Em 2002, o grupo Macmillan foi o primeiro a demonstrar a reação Aldol catalisada por prolina entre diferentes aldeídos . Essa reação é incomum porque, em geral, os aldeídos se autocondicionam.
A reação aldólica organocatalítica intermolecular é agora conhecida como reação Barbas-List Aldol.
Mecanismo de reação
Vários mecanismos de reação para a reação da tricetona foram propostos ao longo dos anos. Hajos e Parrish propuseram o mecanismo de enamina em seu artigo [2] . No entanto, seu experimento com uma quantidade estequiométrica de água marcada (H 2 18 O) apoiou um mecanismo de carbinolamina. Portanto, Hajos propôs (1974) um intermediário hemiaminal . [2] O mecanismo de Agami (1984) tem um intermediário de enamina com duas unidades de prolina envolvidas no estado de transição (com base na cinética de reação experimental ) e de acordo com um mecanismo de Houk (2001) uma única unidade de prolina é suficiente com um estado de transição cíclico e com o grupo prolina carboxila envolvido na ligação de hidrogênio .
O hemiaminal (carbinolamina) proposto por Hajos em 1974 pode se transformar em um intermediário de hidróxido de imínio tautomérico. O íon hidróxido de imínio causou enolização da cadeia lateral metil cetona seria seguida pelo fechamento do anel para o produto cetol bicíclico opticamente ativo mostrado acima (ver Figura 1.) sob a influência da quantidade catalítica de (S) - (-) - prolina . Pengxin Zhou, Long Zhang, Sanzhong Luo e Jin-Pei Cheng obtiveram excelentes resultados usando a amina primária quiral simples t-Bu-CH (NH 2 ) -CH 2 -NEt 2 .TfOH para a síntese de ambas as cetonas de Wieland-Miescher e a cetona Hajos-Parrish, bem como seus análogos. Isso apóia o mecanismo do imínio, porque é a química dos livros didáticos que as aminas primárias formam iminas em vez de enaminas com compostos de carbonila.
O mecanismo da carbinolamina Hajos 1974 teve um apoio involuntário em um artigo mais recente de Michael Limbach. O material de partida tricetona 2- metil-2- (3-oxobutil) -1,3-ciclopentanodiona deu o esperado cetol bicíclico opticamente ativo (+) - (3aS, 7aS) -3a, 4,7,7a-tetrahidro-3a- hidroxi-7a-metil-1,5 (6H) -indanodiona com catalisador (S) - (-) - prolina. Por outro lado, o resultado estereoquímico é revertido com seletividades ee de até 83% usando os catalisadores de aminoácidos homólogos, como (S) -β-homoprolina, [(pirrolidina- (2S) -il) ácido acético]. A anomalia virtual pode ser explicada com uma abordagem do lado superior dos aminoácidos beta mais volumosos para o material de partida tricetona acima de simetria reflexiva. A abordagem do lado superior resulta na formação de uma carbinolamina enantiotópica para dar o (-) - (3aR, 7aR) -3a, 4,7,7a-tetrahidro-3a-hidroxi-7a-metil-1,5 (6H) - enantiómero indanodiona cetol bicíclico idêntico ao obtido com (R) - (+) - prolina não natural. List em 2010, por outro lado, está perplexo e surpreso que Hajos rejeitou o mecanismo de enamina, certamente à luz do trabalho anterior de Spencer em 1965 sobre reações aldólicas catalisadas por amina. É interessante e surpreendente que Eder, Sauer e Wiechert não tenham tentado explicar o mecanismo de reação. [3]
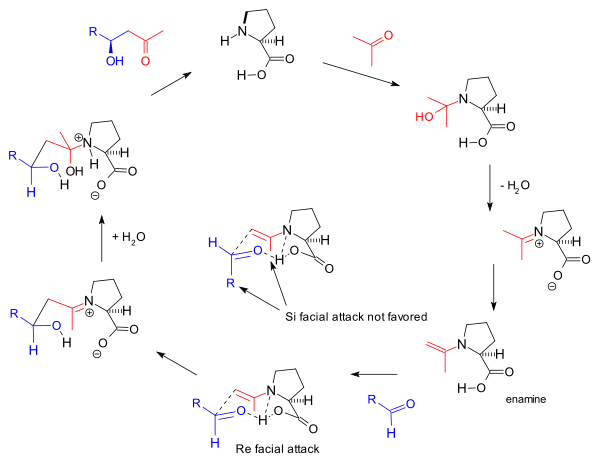
O mecanismo de reação proposto pelo grupo Barbas em 2000 para as reações intermoleculares é baseado também na formação de enamina e na estereosseletividade observada com base no modelo Zimmerman-Traxler que favorece a abordagem Re -face . Este é o mesmo mecanismo proposto por Barbas para anticorpos de aldolase relatado pelo grupo em 1995:
Este mecanismo de enamina também impulsiona a reação tricetona de Hajos-Parrish original, mas o envolvimento de duas moléculas de prolina como proposto por Agami é contestado por Barbas com base na falta de efeitos não lineares e apoiado por estudos posteriores de List com base na cinética da reação . O mecanismo geral é ainda apoiado por List pela descoberta de que em uma reação realizada em água rotulada (H 2 18 O), o isótopo de oxigênio encontra seu caminho para o produto da reação. O experimento de Hajos e Parrish com uma quantidade estequiométrica de água rotulada (H 2 18 O) apoiou o mecanismo da carbinolamina. [2]
No mesmo estudo [20], a reação da prolina com acetona à oxazolidinona (em DMSO ) foi examinada:
A constante de equilíbrio para essa reação é de apenas 0,12, levando List a concluir que o envolvimento da oxazolidinona é apenas parasitário.
Blackmond em 2004 também encontrou oxazolidinonas como intermediários (NMR) em uma α-aminooxilação catalisada por prolina de propanal com nitrosobenzeno :
Chiong Teck Wong do Instituto de Computação de Alto Desempenho de Cingapura estudou a reação de oxiaminação semelhante de nitrosobenzeno com butanal usando um catalisador de éter silílico de prolinol quiral . Seus estudos sugerem fortemente que o catalisador gera o enol e forma um complexo enol-catalisador. O nitrosobenzeno subsequentemente reage com o complexo enol-catalisador para fornecer o produto (S) -N-nitroso aldol de acordo com o gráfico de eletronegatividade de Pauling. A redução de boro-hidreto de sódio dos produtos aldólicos formados principalmente deu os álcoois correspondentes com bom rendimento e excelente enantiosseletividade na proporção de P N / P O => 99: 1 como mostrado no Esquema abaixo. Wong sugere que o mecanismo de reação da reação N-nitroso aldol catalisada por (S) -Cat entre nitrosobenzeno e butanal prossegue através de um intermediário enol e não através de um intermediário enamina.
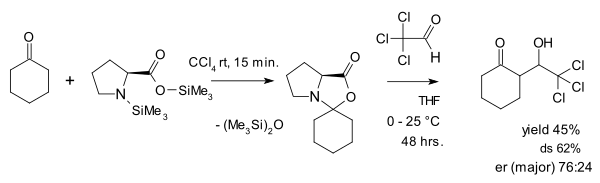
A visão das oxazolidinonas como uma espécie parasitária é contestada por Seebach e Eschenmoser, que em 2007 publicaram um artigo no qual argumentam que as oxazolidinonas, de fato, desempenham um papel central na catálise da prolina. Uma das coisas que eles fizeram foi reagir uma oxazolidinona com o aldeído cloral ativado em uma adição de aldol:
Em 2008, Barbas em um ensaio abordou a questão de por que demorou até o ano 2000 para regenerar o interesse por essa reação aparentemente simples, 30 anos após o trabalho pioneiro de Hajos e Parrish e por que o mecanismo de catálise da prolina pareceu ser um enigma por tanto tempo. Uma explicação tem a ver com diferentes culturas científicas: um mecanismo de prolina no contexto da catálise de aldolase já postulado em 1964 por um bioquímico foi ignorado pelos químicos orgânicos. Outra parte da explicação era a suposta complexidade da catálise de aldolase que dominou o pensamento químico por um longo tempo. Finalmente, a pesquisa não se expandiu nesta área na Hoffmann-La Roche após a renúncia do ZGH em novembro de 1970.
Origem do nome da reação
O nome para essa reação levou algum tempo para ser desenvolvido. Em 1985, o professor Agami e associados foram os primeiros a nomear a anulação de Robinson catalisada por prolina como reação Hajos-Parrish. Em 1986, o professor Henri B. Kagan e o professor Agami ainda a chamavam de reação Hajos-Parrish no resumo deste artigo. Em 2001, Kagan publicou um artigo intitulado "Nonlinear Effects in Asymmetric Catalysis: A Personal Account" em Synlett . Neste artigo, ele apresentou o novo título, a reação Hajos-Parrish-Wiechert. Em 2002, Benjamin List acrescentou mais dois nomes e introduziu o termo reação Hajos – Parrish – Eder – Sauer – Wiechert. Artigos científicos publicados até 2008 no campo da organocatálise usam os nomes de 1985, 2001 ou 2002 da reação. Uma pesquisa de junho de 2014 limitada aos anos de 2009-2014 pelo Google Scholar retorna 44 resultados para a reação Hajos-Parrish, 3 para a reação Hajos-Parrish-Wiechert e 184 para a reação Hajos-Parrish-Eder-Sauer-Wiechert. O termo 'cetona Hajos-Parrish' (e semelhantes) permanece comum, no entanto.