Reação de adição de halogênio - Halogen addition reaction
Uma reação de adição de halogênio é uma reação orgânica simples em que uma molécula de halogênio é adicionada à ligação dupla carbono-carbono de um grupo funcional alceno .
A fórmula química geral da reação de adição de halogênio é:
- C = C + X 2 → X − C − C − X
(X representa os halogênios bromo ou cloro e, neste caso, um solvente poderia ser CH 2 Cl 2 ou CCl 4 ). O produto é um dihalide vicinal .
Este tipo de reação é uma halogenação e uma adição eletrofílica .
Mecanismo de reação
O mecanismo de reação para uma bromação de alceno pode ser descrito como segue. Na primeira etapa da reação, uma molécula de bromo se aproxima da dupla ligação carbono-carbono alceno rico em elétrons. O átomo de bromo mais próximo da ligação assume uma carga parcial positiva à medida que seus elétrons são repelidos pelos elétrons da ligação dupla.

|
|
| Adição de bromo ao mecanismo de reação de alceno | Um íon brometo ataca o C – Br σ * orbital molecular anti-ligação de um íon bromônio |
O átomo é eletrofílico neste momento e é atacado pelos elétrons pi do alceno [ligação dupla carbono-carbono]. Ele forma por um instante uma única ligação sigma para ambos os átomos de carbono envolvidos. A ligação do bromo é especial neste intermediário, devido ao seu tamanho relativamente grande em comparação ao carbono , o íon brometo é capaz de interagir com os dois carbonos que antes compartilhavam a ligação π , formando um anel de três membros. O íon brometo adquire uma carga formal positiva. Neste momento, o íon halogênio é denominado " íon bromônio " ou " íon clorônio ", respectivamente.
Quando o primeiro átomo de bromo ataca a ligação π carbono-carbono, ele deixa para trás um de seus elétrons com o outro bromo ao qual estava ligado em Br 2 . Esse outro átomo agora é um ânion brometo negativo e é atraído pela leve carga positiva nos átomos de carbono. É bloqueado do ataque nucleofílico de um lado da cadeia de carbono pelo primeiro átomo de bromo e só pode atacar do outro lado. À medida que ataca e forma uma ligação com um dos carbonos, a ligação entre o primeiro átomo de bromo e os outros átomos de carbono se quebra, deixando cada átomo de carbono com um substituinte de halogênio.
Desta forma, os dois halogênios são adicionados de forma anti- adição e, quando o alceno faz parte de um ciclo, o dibrometo adota a configuração trans . Para a sobreposição máxima do orbital molecular anticoagulante C – Br σ * (o LUMO , mostrado à direita em vermelho) e o par solitário de nucleófilos (X - ) (o HOMO , mostrado à direita abaixo em verde), X - deve atacar o íon bromônio por trás, no carbono.
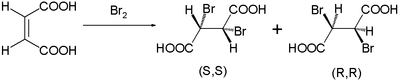
Este mecanismo de reação foi proposto por Roberts e Kimball em 1937. Com ele eles explicaram as adições trans estereoespecíficas observadas nas bromações de ácido maleico e ácido fumárico . O ácido maleico com uma ligação dupla cis forma o dibrometo como uma mistura de enantiômeros :
enquanto o ácido fumárico isômero trans forma um único composto meso :
A reacção é ainda estereoespecífica em alcenos com dois volumosos terc -butilo grupos em uma cis posição que no composto de cis -di- terc -butylethylene. Apesar da repulsão estérica presente no ião chloronium, o único produto formado é o anti -adduct.
β-Halocarbocations
Em um esquema de reação alternativo representado abaixo, o intermediário reativo é um íon β-bromocarbocation ou β-bromocarbonium com um dos átomos de carbono um carbocation genuíno .
Para reações que ocorrem por meio desse mecanismo, nenhuma estereoespecificidade é esperada e, de fato, não foi encontrada.
Roberts e Kimball em 1937 já explicaram o fato de que as bromações com o íon maleato resultaram na adição cis conduzida pela repulsão entre os ânions do ácido carboxílico negativamente carregados sendo mais fortes do que a formação do íon halônio. Em alquenos, como anetholes e estilbenos, os substituintes são capazes de estabilizar o carbocátion, doando elétrons às custas do íon halônio.
Os íons halônio podem ser identificados por meio de espectroscopia de NMR . Em 1967, o grupo de George A. Olah obteve espectros de RMN de íons tetrametilenobbromônio por dissolução de 2,3-dibromo-2,3-dimetilbutano em ácido mágico a -60 ° C. O espectro para o composto de flúor correspondente , por outro lado, era consistente com um par de β-fluorocarbocações de equilíbrio rápido .
Veja também
- Exemplo de bromação na síntese de Auwers