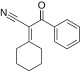
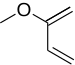
Reação de Diels-Alder de demanda inversa de elétrons - Inverse electron-demand Diels–Alder reaction

A reação de Diels-Alder de demanda inversa de elétrons , ou DA INV ou IEDDA, é uma reação química orgânica, na qual duas novas ligações químicas e um anel de seis membros são formados. Está relacionado à reação de Diels-Alder , mas ao contrário da reação de Diels-Alder (ou DA ), o DA INV é uma cicloadição entre um dienófilo rico em elétrons e um dieno pobre em elétrons . Durante uma reação DA INV , três ligações pi são quebradas, e duas ligações sigma e uma nova ligação pi são formadas. Uma reação DA INV prototípica é mostrada à direita.
As reações DA INV frequentemente envolvem heteroátomos e podem ser usadas para formar compostos heterocíclicos . Isso torna a reação DA INV particularmente útil em sínteses de produtos naturais, onde os compostos alvo geralmente contêm heterociclos. Recentemente, a reação DA INV foi usada para sintetizar um sistema de transporte de drogas que tem como alvo o câncer de próstata .
História
A reação de Diels-Alder foi relatada pela primeira vez em 1928 por Otto Diels e Kurt Alder ; eles receberam o Prêmio Nobel de Química por seu trabalho em 1950. Desde então, o uso da reação de Diels-Alder se espalhou. Por outro lado, DA INV não tem uma data clara de início e carece da proeminência comparativa da reação de Diels-Alder padrão. DA INV não tem uma data clara de descoberta, devido à dificuldade que os químicos tinham em diferenciar as reações de Diels-Alder normais das de demanda inversa de elétrons antes do advento dos métodos computacionais modernos. Muito do trabalho nesta área é atribuído a Dale Boger , embora outros autores tenham publicado vários artigos sobre o assunto.
Mecanismo
Mecanismo formal
O mecanismo da reação DA INV é controverso. Embora seja aceito como uma cicloadição formal [4 + 2] , não é bem compreendido se a reação é realmente combinada ou não . A visão aceita é que a maioria das reações DA INV ocorrem por meio de um mecanismo assíncrono. A reação prossegue por meio de um único estado de transição, mas nem todas as ligações são formadas ou quebradas ao mesmo tempo, como seria o caso em um mecanismo combinado .
O mecanismo formal DA INV para a reação da acroleína e do éter metilvinílico é mostrado na figura à direita. Embora não seja totalmente preciso, ele fornece um modelo útil para a reação. Durante o curso da reação, três ligações pi (marcadas em vermelho) são quebradas e três novas ligações são formadas (marcadas em azul): duas ligações sigma e uma nova ligação pi .
Estado de transição
Como o DA padrão, as reações DA INV ocorrem por meio de um único estado de transição de barco , apesar de não serem combinadas. O estado de transição de barco único é uma simplificação, mas os cálculos DFT sugerem
que a diferença de tempo na cisão e formação da ligação é mínima e que, apesar da potencial assincronicidade, a reação é combinada, com ligações relevantes sendo parcialmente quebradas ou parcialmente formadas em algum ponto durante a reação. A quase sincronicidade do DA INV significa que pode ser tratado de forma semelhante à reação de Diels-Alder padrão.
A reação pode ser modelada usando um estado de transição fechado, semelhante a um barco, com todas as ligações em processo de formação ou quebra em algum ponto dado e, portanto, deve obedecer às regras de seleção gerais de Woodward-Hoffman . Isso significa que, para um sistema de três componentes e seis elétrons, todos os componentes devem interagir de maneira suprafacial (ou um suprafacial e dois antarfaciais ). Com todos os componentes sendo suprafaciais, o estado de transição permitido é semelhante a um barco; um estado de transição semelhante a uma cadeira resultaria em três componentes antarafaciais de dois elétrons. O case semelhante a uma cadeira não é permitido termicamente pelas regras de Woodward-Hoffman.
Teoria orbital molecular
Reações DA padrão
Na reação de Diels-Alder padrão, há dois componentes: o dieno , que é rico em elétrons, e o dienófilo , que é pobre em elétrons. A relativa riqueza e deficiência de elétrons dos reagentes pode ser melhor descrita visualmente, em um diagrama orbital molecular . No Diels-Alder padrão, o dieno rico em elétrons tem orbitais moleculares que são mais elevados em energia do que os orbitais do dienófilo pobre em elétrons . Esta diferença nas energias orbitais relativas significa que, dos orbitais moleculares de fronteira, o HOMO do dieno (HOMO dieno ) e o LUMO do dienófilo (LUMO dienófilo ) são mais semelhantes em energia do que o HOMO dienófilo e o LUMO dieno . A interação orbital mais forte ocorre entre os orbitais moleculares de fronteira mais semelhantes: HOMO dieno e LUMO dienófilo .

[4 + 2] reações de dimerização
As reações de dimerização não são normalmente ou inversamente aceleradas e geralmente têm baixo rendimento. Nesse caso, dois monômeros reagem de maneira DA. Como as energias orbitais são idênticas, não há preferência pela interação do HOMO ou do LUMO do dieno ou do dienófilo. O baixo rendimento das reações de dimerização é explicado pela teoria de perturbação de segunda ordem . O LUMO e o HOMO de cada espécie estão mais distantes em energia em uma dimerização do que em Diels-Alder normalmente ou inversamente acelerado. Isso significa que os orbitais interagem menos e há um impulso termodinâmico mais baixo para a dimerização.

Diels-Alder com demanda inversa de elétrons
Nas reações de dimerização, o dieno e o dienófilo eram igualmente ricos em elétrons (ou igualmente pobres em elétrons). Se o dieno se tornar menos rico em elétrons, ou o dienófilo ainda mais, a possível reação de cicloadição [4 + 2] será uma reação DA INV . Na reação DA INV , o dieno LUMO e o dienófilo HOMO estão mais próximos em energia do que o dieno HOMO e o dienófilo LUMO . Assim, o dieno LUMO e o dienófilo HOMO são os orbitais de fronteira que interagem mais fortemente e resultam na formação de ligações mais energeticamente favorável.
Regioquímica e estereoquímica de DA INV
Regioquímica
A regioquímica em reações DA INV pode ser prevista com segurança em muitos casos. Isso pode ser feito de duas maneiras, por controle eletrostático (carga) ou controle orbital. Para prever a regioquímica via controle de carga, deve-se considerar as formas de ressonância dos reagentes. Essas formas de ressonância podem ser usadas para atribuir cargas parciais a cada um dos átomos. Os átomos parcialmente negativos no dieno se ligarão a átomos parcialmente positivos no dienófilo e vice-versa.

A previsão da regioquímica da reação via controle orbital requer que se calcule os coeficientes orbitais relativos em cada átomo dos reagentes. O HOMO do dienófilo reage com o LUMO do dieno. O tamanho orbital relativo em cada átomo é representado por coeficientes orbitais na teoria orbital molecular Frontier (FMO). Os orbitais se alinharão para maximizar as interações de ligação e minimizar as interações anti-ligação.
Princípio de Alder-Stein
O princípio de Alder-Stein afirma que a estereoquímica dos reagentes é mantida na estereoquímica dos produtos durante uma reação de Diels-Alder. Isto significa que os grupos que eram cis em relação uns aos outros nos materiais de partida serão sincronizados uns com os outros no produto e os grupos que eram trans entre si no material de partida serão anti no produto.
É importante notar que o princípio de Alder-Stein não tem relação com a orientação relativa dos grupos nas duas matérias-primas. Não se pode prever, por meio deste princípio, se um substituinte no dieno será sin ou anti a um substituinte no dienófilo. O princípio de Alder-Stein é consistente apenas nos mesmos materiais de partida. A relação só é válida para os grupos do dieno sozinho, ou os grupos do dienófilo, sozinho. A orientação relativa dos grupos entre os dois reagentes pode ser prevista pela regra de seleção endo .
Regra de seleção de Endo
Similarmente à reação de Diels-Alder padrão, o DA INV também obedece a uma regra geral de seleção endo. No Diels-Alder padrão, sabe-se que os grupos de retirada de elétrons no dienófilo se aproximarão do endo, em relação ao dieno. A causa exata dessa seletividade ainda é debatida, mas a visão mais aceita é que a abordagem endo maximiza a sobreposição orbital secundária.
The DAINV favors an endo orientation of electron donating substituents on the dienophile. Since all Diels–Alder reactions proceed through a boat transition state, there is an "inside" and an "outside" of the transition state (inside and outside the "boat"). The substituents on the dienophile are considered "endo" if they are 'inside' the boat, and "exo" if they are on the outside.
A via exo seria favorecida por estéricos, portanto, uma explicação diferente é necessária para justificar a predominância geral de produtos endo. A teoria orbital molecular de fronteira pode ser usada para explicar esse resultado. Quando os substituintes do dienófilo são exo, não há interação entre esses substituintes e o dieno. No entanto, quando os substituintes dienófilos são endo, há considerável sobreposição orbital com o dieno. No caso de DA INV, a sobreposição dos orbitais dos substituintes que retiram elétrons com os orbitais do dieno cria uma interação de ligação favorável , estabilizando o estado de transição em relação ao estado de transição exo. A reação com a energia de ativação mais baixa ocorrerá em uma taxa maior.
Dienes comuns
Os dienos usados em Diels-Alder de demanda inversa de elétrons são espécies relativamente deficientes em elétrons; em comparação com o Diels-Alder padrão, onde o dieno é rico em elétrons. Essas espécies pobres em elétrons têm energias orbitais moleculares mais baixas do que suas contrapartes DA padrão. Essa energia reduzida resulta da inclusão de: A) grupo de retirada de elétrons ou B) heteroátomos eletronegativos. Os compostos aromáticos também podem reagir em reações DA INV , como as triazinas e as tetrazinas . Outras classes comuns de dienos são oxo- e aza -butadienos.
A qualidade chave de um bom dieno DA INV é um HOMO e LUMO significativamente reduzidos, em comparação com os dienos DA padrão. Abaixo está uma tabela que mostra alguns dienos DA INV comumente usados , suas energias HOMO e LUMO, e alguns dienos DA padrão, junto com suas respectivas energias MO.
| Diene | Nome | Energia HOMO (eV) | Energia LUMO (eV) | Via de reação (DA / DA INV ) |
|---|---|---|---|---|
| 2-ciclohexilideno-3-oxo-3-fenilpropanonitrila | -9.558 | 2,38 | DA INV | |
| Acroleína | -14,5 | 2,5 | DA INV | |
| 5-ciclopentilideno-1,3-dimetilpirimidina-2,4,6 (1H, 3H, 5H) -triona | -10.346 | 1.879 | DA INV | |
| Butadieno | -10.346 | 1.879 | DA ou DA INV | |
| 1-metoxibutadieno | -8,21 | 3,77 | DA | |
| 2,3-dimetil-butadieno | -8,76 | 2,18 | DA |
Dienófilos comuns
Os dienófilos usados nas reações de Diels-Alder de demanda inversa de elétrons são, ao contrário do DA padrão, muito ricos em elétrons, contendo um ou mais grupos doadores de elétrons . Isso resulta em energias orbitais mais altas e, portanto, mais sobreposição orbital com o LUMO do dieno. As classes comuns de dieneófilos para a reação DA INV incluem éteres vinílicos e acetais vinílicos, iminas, enaminas, alcinos e olefinas altamente tensas.
A consideração mais importante na escolha do dienófilo são suas energias orbitais relativas. Tanto o HOMO quanto o LUMO afetam a taxa e a seletividade da reação. Uma tabela de dienófilos DA INV comuns , dienófilos DA padrão e suas respectivas energias de MO podem ser vistos abaixo.
| Dienófilo | Nome | Energia HOMO (eV) | Energia LUMO (eV) | Via de reação (DA / DA INV ) |
|---|---|---|---|---|
| etil vinil éter | -9,006 | 5,313 | DA INV | |
| 2-metilenotetrahidro-2H-pirano | -8.939 | 5.140 | DA INV | |
| 1,1'-bis (ciclopentilideno) | -8,242 | 4.749 | DA INV | |
| Acroleína | -14,5 | 2,5 | DA | |
| Ciclohexeno | -8,94 | 2,1 | DA | |
| Propeno | -9,13 | 1,8 | DA | |
| Etileno | -10,52 | 1,5 | DA |
Uma segunda tabela mostra como a riqueza de elétrons nos dienófilos afeta a taxa de reação com um dieno muito pobre em elétrons, ou seja, hexaclorociclopentadieno . Quanto mais rico em elétrons for o dienófilo, maior será a taxa de reação. Isso fica muito claro ao comparar as taxas relativas de reação do estireno e do p-nitroestireno menos rico em elétrons ; o estireno mais rico em elétrons reage cerca de 40% mais rápido do que o p-nitroestireno.
| Dienófilo | Taxa de reação relativa com |
|---|---|
| Ciclopentadieno | 15200 |
| p-metoxiestireno | 1580 |
| Estireno | 750 |
| p-nitroestireno | 538 |
| 2,3-dihidrofurano | 333 |
| Norbornene | 70,8 |
| Ciclopenteno | 59,0 |
| Anidrido maleico | 29,1 |
| Ciclohexeno | 3,0 |
Escopo e aplicações
As reações DA INV fornecem um caminho para uma rica biblioteca de alvos sintéticos e têm sido utilizadas para formar muitos sistemas altamente funcionalizados, incluindo açúcares seletivamente protegidos, uma contribuição importante para o campo da química do açúcar. Além disso, as reações DA INV podem produzir uma variedade de produtos diferentes a partir de um único material de partida, como a tetrazina.
As reações DA INV têm sido utilizadas para a síntese de vários produtos naturais, incluindo (-) - CC-1065, um composto original da série da Duocarmicina , que encontrou uso como tratamento anticâncer. Vários candidatos a medicamentos nesta série progrediram em ensaios clínicos. A reação DA INV foi usada para sintetizar as seções PDE-I e PDE-II de (-) - CC-1065. A primeira reação na sequência é uma reação DA INV entre a tetrazina e o vinil acetal , seguida por uma reação retro-Diels-Alder para produzir um produto 1,2- diazina . Após várias outras etapas, ocorre uma reação intramolecular DA INV , seguida novamente por um retro Diels-Alder in situ, para produzir um produto indolina . Esta indolina é convertida em PDE-I ou PDE-II em algumas etapas sintéticas.

A reação DA INV entre 2,3,4,5-tetraclorotiofeno-1,1-dióxido (dieno) e derivado de 4,7-di-hidroisoindol (dienófilo) proporcionou um novo precursor para tetranaftoporfirinas (TNP) com anéis aromáticos perclorados. Este precursor pode ser transformado nas porfirinas correspondentes por condensação catalisada por ácido de Lewis com aldeídos aromáticos e posterior oxidação por DDQ . A policloração do sistema TNP tem um efeito profundamente favorável em sua solubilidade. A forte agregação e a baixa solubilidade das tetranaftoporfirinas parentais degradam severamente a utilidade desta família de porfirinas potencialmente muito valiosa. Assim, o efeito observado da policloração é muito bem-vindo. Além do efeito sobre a solubilidade, a policloração também acabou melhorando substancialmente a estabilidade desses compostos em relação à fotooxidação , o que é conhecido por ser outra desvantagem séria das tetranaftoporfirinas.
Veja também
- Reação de Diels-Alder
- Cycloaddition
- Reação pericíclica
- Teoria orbital molecular
- Síntese de boger piridina