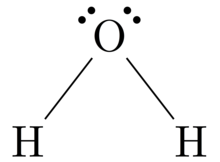
Estrutura de Lewis - Lewis structure
Estruturas de Lewis , também conhecidos como Lewis dot fórmulas, Lewis dot estruturas , electrões salpicam estruturas , ou de electrões ponto estruturas de Lewis (LEDs) , são diagramas que mostram a ligação entre átomos de uma molécula , bem como os pares isolados de electrões que podem existir na molécula. Uma estrutura de Lewis pode ser desenhada para qualquer molécula ligada covalentemente , bem como compostos de coordenação . A estrutura de Lewis recebeu o nome de Gilbert N. Lewis , que a introduziu em seu artigo de 1916, The Atom and the Molecule. As estruturas de Lewis estendem o conceito do diagrama de pontos do elétron adicionando linhas entre os átomos para representar os pares compartilhados em uma ligação química.
As estruturas de Lewis mostram cada átomo e sua posição na estrutura da molécula usando seu símbolo químico. Linhas são desenhadas entre átomos que estão ligados uns aos outros (pares de pontos podem ser usados em vez de linhas). O excesso de elétrons que formam pares isolados são representados como pares de pontos e são colocados próximos aos átomos.
Embora os elementos do grupo principal do segundo período e além geralmente reajam ganhando, perdendo ou compartilhando elétrons até que tenham alcançado uma configuração de elétron de camada de valência com um octeto completo de (8) elétrons, o hidrogênio (H) só pode formar ligações que compartilham apenas dois elétrons.
Construção e contagem de elétrons
O número total de elétrons representados em uma estrutura de Lewis é igual à soma do número de elétrons de valência em cada átomo individual. Os elétrons de não valência não são representados nas estruturas de Lewis.
Uma vez que o número total de elétrons disponíveis foi determinado, os elétrons devem ser colocados na estrutura de acordo com estas etapas:
- Os átomos são primeiro conectados por ligações simples.
- Se t é o número total de elétrons en o número de ligações simples, t-2n elétrons ainda precisam ser colocados. Eles devem ser colocados como pares isolados: um par de pontos para cada par de elétrons disponível. Os pares solitários devem inicialmente ser colocados nos átomos externos (exceto hidrogênio) até que cada átomo externo tenha oito elétrons em pares de ligação e pares solitários; pares solitários extras podem então ser colocados no átomo central. Em caso de dúvida, os pares solitários devem ser colocados em átomos mais eletronegativos primeiro.
- Depois que todos os pares isolados são colocados, os átomos (especialmente os átomos centrais) podem não ter um octeto de elétrons. Nesse caso, os átomos devem formar uma ligação dupla; um único par de elétrons é movido para formar uma segunda ligação entre os dois átomos. Como o par de ligação é compartilhado entre os dois átomos, o átomo que originalmente tinha o par solitário ainda tem um octeto; o outro átomo agora tem mais dois elétrons em sua camada de valência.
As estruturas de Lewis para íons poliatômicos podem ser desenhadas pelo mesmo método. Ao contar elétrons, os íons negativos devem ter elétrons extras colocados em suas estruturas de Lewis; íons positivos devem ter menos elétrons do que uma molécula sem carga. Quando a estrutura de Lewis de um íon é escrita, toda a estrutura é colocada entre colchetes e a carga é escrita em sobrescrito no canto superior direito, fora dos colchetes.
Um método mais simples foi proposto para a construção de estruturas de Lewis, eliminando a necessidade de contagem de elétrons: os átomos são desenhados mostrando os elétrons de valência; ligações são então formadas pelo emparelhamento de elétrons de valência dos átomos envolvidos no processo de formação de ligações, e ânions e cátions são formados pela adição ou remoção de elétrons de / para os átomos apropriados.
Um truque é contar os elétrons de valência, depois contar o número de elétrons necessários para completar a regra do octeto (ou com o hidrogênio apenas 2 elétrons) e, em seguida, calcular a diferença desses dois números. A resposta é o número de elétrons que formam as ligações. O resto dos elétrons apenas vão para preencher os octetos de todos os outros átomos.
Outro procedimento simples e geral para escrever estruturas de Lewis e formas de ressonância foi proposto.
Cobrança formal
Em termos de estruturas de Lewis, a carga formal é usada na descrição, comparação e avaliação de estruturas topológicas e de ressonância prováveis , determinando a carga eletrônica aparente de cada átomo, com base em sua estrutura de pontos de elétrons, assumindo covalência exclusiva ou ligação não polar . Tem utilidade na determinação de possível reconfiguração do elétron quando se refere a mecanismos de reação , e freqüentemente resulta no mesmo sinal da carga parcial do átomo, com exceções. Em geral, a carga formal de um átomo pode ser calculada usando a seguinte fórmula, assumindo definições não padrão para a marcação usada:
Onde:
- é a acusação formal.
- representa o número de elétrons de valência em um átomo livre do elemento.
- representa o número de elétrons não compartilhados no átomo.
- representa o número total de elétrons em ligações que o átomo tem com outro.
A carga formal de um átomo é calculada como a diferença entre o número de elétrons de valência que um átomo neutro teria e o número de elétrons que pertencem a ele na estrutura de Lewis. Elétrons em ligações covalentes são divididos igualmente entre os átomos envolvidos na ligação. O total das cargas formais em um íon deve ser igual à carga no íon, e o total das cargas formais em uma molécula neutra deve ser igual a zero.
Ressonância
Para algumas moléculas e íons, é difícil determinar quais pares solitários devem ser movidos para formar ligações duplas ou triplas, e duas ou mais estruturas de ressonância diferentes podem ser escritas para a mesma molécula ou íon. Nesses casos, é comum escrever todos eles com setas de mão dupla no meio (consulte o exemplo abaixo). Às vezes, esse é o caso quando vários átomos do mesmo tipo circundam o átomo central e é especialmente comum para íons poliatômicos.
Quando essa situação ocorre, diz-se que a estrutura de Lewis da molécula é uma estrutura de ressonância , e a molécula existe como um híbrido de ressonância. Cada uma das diferentes possibilidades é sobreposta às outras, e a molécula é considerada como tendo uma estrutura de Lewis equivalente a alguma combinação desses estados.
O íon nitrato (NO 3 - ), por exemplo, deve formar uma ligação dupla entre o nitrogênio e um dos oxigênios para satisfazer a regra do octeto para o nitrogênio. No entanto, como a molécula é simétrica, não importa qual dos oxigênios forma a ligação dupla. Neste caso, existem três estruturas de ressonância possíveis. A expressão de ressonância ao desenhar estruturas de Lewis pode ser feita desenhando cada uma das formas de ressonância possíveis e colocando setas duplas entre elas ou usando linhas tracejadas para representar as ligações parciais (embora a última seja uma boa representação do híbrido de ressonância que é não, formalmente falando, uma estrutura de Lewis).
Ao comparar estruturas de ressonância para a mesma molécula, geralmente aquelas com menos cargas formais contribuem mais para o híbrido de ressonância geral. Quando cargas formais são necessárias, as estruturas de ressonância que têm cargas negativas nos elementos mais eletronegativos e cargas positivas nos elementos menos eletronegativos são favorecidas.
As ligações simples também podem ser movidas da mesma maneira para criar estruturas de ressonância para moléculas hipervalentes , como hexafluoreto de enxofre , que é a descrição correta de acordo com cálculos químicos quânticos em vez do modelo de octeto expandido comum.
A estrutura de ressonância não deve ser interpretada para indicar que a molécula alterna entre as formas, mas que a molécula atua como a média de múltiplas formas.
Exemplo
A fórmula do íon nitrito é NO-
2.
- O nitrogênio é o átomo menos eletronegativo dos dois, então é o átomo central por vários critérios.
- Conte os elétrons de valência. O nitrogênio tem 5 elétrons de valência; cada oxigênio tem 6, para um total de (6 × 2) + 5 = 17. O íon tem uma carga de -1, o que indica um elétron extra, então o número total de elétrons é 18.
- Conecte os átomos por ligações simples. Cada oxigênio deve estar ligado ao nitrogênio, que usa quatro elétrons - dois em cada ligação.
- Coloque pares solitários. Os 14 elétrons restantes devem inicialmente ser colocados como 7 pares solitários. Cada oxigênio pode levar no máximo 3 pares isolados, dando a cada oxigênio 8 elétrons, incluindo o par de ligação. O sétimo par solitário deve ser colocado no átomo de nitrogênio.
- Satisfaça a regra do octeto. Ambos os átomos de oxigênio têm atualmente 8 elétrons atribuídos a eles. O átomo de nitrogênio tem apenas 6 elétrons atribuídos a ele. Um dos pares solitários em um átomo de oxigênio deve formar uma ligação dupla, mas qualquer um dos átomos funcionará igualmente bem. Portanto, existe uma estrutura de ressonância.
- Amarre as pontas soltas. Duas estruturas de Lewis devem ser desenhadas: Cada estrutura tem um dos dois átomos de oxigênio com ligação dupla ao átomo de nitrogênio. O segundo átomo de oxigênio em cada estrutura terá uma ligação simples ao átomo de nitrogênio. Coloque colchetes ao redor de cada estrutura e adicione a carga (-) no canto superior direito fora dos colchetes. Desenhe uma seta de duas pontas entre as duas formas de ressonância.
Formações alternativas

Estruturas químicas podem ser escritas em formas mais compactas, particularmente quando mostram moléculas orgânicas . Em fórmulas estruturais condensadas, muitas ou mesmo todas as ligações covalentes podem ser deixadas de fora, com os subscritos indicando o número de grupos idênticos ligados a um átomo particular. Outro diagrama estrutural abreviado é a fórmula do esqueleto (também conhecida como fórmula da linha de ligação ou diagrama do esqueleto de carbono). Em uma fórmula esquelética, os átomos de carbono não são representados pelo símbolo C, mas pelos vértices das linhas. Os átomos de hidrogênio ligados ao carbono não são mostrados - eles podem ser inferidos contando o número de ligações a um átomo de carbono específico - cada carbono é assumido como tendo quatro ligações no total, então quaisquer ligações não mostradas são, por implicação, para átomos de hidrogênio.
Outros diagramas podem ser mais complexos do que as estruturas de Lewis, mostrando ligações em 3D usando várias formas, como diagramas de preenchimento de espaço .
Uso e limitações
Apesar de sua simplicidade e desenvolvimento no início do século XX, quando a compreensão das ligações químicas ainda era rudimentar, as estruturas de Lewis capturam muitas das principais características da estrutura eletrônica de uma variedade de sistemas moleculares, incluindo aqueles de relevância para a reatividade química. Assim, eles continuam a ser amplamente utilizados por químicos e educadores em química. Isso é especialmente verdadeiro no campo da química orgânica , onde o modelo tradicional de ligação de valência ainda domina, e os mecanismos são frequentemente entendidos em termos de notação de seta curva sobreposta a fórmulas esqueléticas , que são versões abreviadas de estruturas de Lewis. Devido à maior variedade de esquemas de ligação encontrados na química inorgânica e organometálica , muitas das moléculas encontradas requerem o uso de orbitais moleculares totalmente deslocalizados para descrever adequadamente suas ligações, tornando as estruturas de Lewis comparativamente menos importantes (embora ainda sejam comuns).
É importante notar que existem sistemas moleculares simples e arquetípicos para os quais uma descrição de Lewis, pelo menos na forma não modificada, é enganosa ou imprecisa. Notavelmente, o desenho ingênuo de estruturas de Lewis para moléculas conhecidas experimentalmente por conter elétrons desemparelhados (por exemplo, O 2 , NO e ClO 2 ) leva a inferências incorretas de ordens de ligação, comprimentos de ligação e / ou propriedades magnéticas. Um modelo simples de Lewis também não leva em consideração o fenômeno da aromaticidade . Por exemplo, as estruturas de Lewis não oferecem uma explicação de por que o C 6 H 6 (benzeno) cíclico experimenta uma estabilização especial além dos efeitos de deslocalização normais, enquanto o C 4 H 4 (ciclobutadieno) na verdade experimenta uma desestabilização especial . A teoria orbital molecular fornece a explicação mais direta para esses fenômenos.
Veja também
- Teoria de repulsão do par de elétrons da camada de valência
- Geometria molecular
- Fórmula estrutural
- Orbital de ligação natural