Bateria de lítio-ar - Lithium–air battery
| Energia especifica | 40.104.000 J / kg (teórico) |
|---|---|
| Densidade de energia | ? J / m³ |
| Poder específico | 11.400 W / kg |
| Tensão nominal da célula | 2,91 V |
A bateria de lítio-ar ( Li-ar ) é uma célula eletroquímica metal-ar ou química de bateria que usa a oxidação do lítio no ânodo e a redução do oxigênio no cátodo para induzir um fluxo de corrente.
O emparelhamento de lítio e oxigênio ambiente pode teoricamente levar a células eletroquímicas com a maior energia específica possível . Na verdade, a energia específica teórica de uma bateria de Li-ar não aquosa, no estado carregado com o produto Li 2 O 2 e excluindo a massa de oxigênio, é de ~ 40,1 MJ / kg. Isso é comparável à energia específica teórica da gasolina, ~ 46,8 MJ / kg. Na prática, baterias de lítio-ar com uma energia específica de ~ 6,12 MJ / kg no nível da célula foram demonstradas. Isso é cerca de 5 vezes maior do que uma bateria comercial de íon-lítio e é suficiente para operar um veículo elétrico de 2.000 kg por aproximadamente 500 km (310 milhas) com uma única carga usando 60 kg de baterias. No entanto, a potência prática e o ciclo de vida das baterias de ar lítio precisam de melhorias significativas antes que possam encontrar um nicho de mercado.
Avanços eletrolíticos significativos são necessários para desenvolver uma implementação comercial. Quatro abordagens estão sendo consideradas: aprótica , aquosa , de estado sólido e mista aquoso-aprótica.
Um dos principais direcionadores de mercado para baterias é o setor automotivo. A densidade de energia da gasolina é de aproximadamente 13 kW · h / kg, o que corresponde a 1,7 kW · h / kg de energia fornecida às rodas após as perdas. Teoricamente, o lítio-ar pode atingir 12 kW · h / kg (43,2 MJ / kg) excluindo a massa de oxigênio. Levando em consideração o peso da bateria completa (carcaça, canais de ar, substrato de lítio), embora o lítio sozinho seja muito leve, a densidade de energia é consideravelmente mais baixa.
História
Originalmente propostas na década de 1970 como uma possível fonte de energia para veículos elétricos a bateria e veículos elétricos híbridos , as baterias Li-air retomaram o interesse científico no final da primeira década dos anos 2000 devido aos avanços na ciência dos materiais .
Embora a ideia de uma bateria de lítio-ar já existisse muito antes de 1996, a relação risco-benefício era considerada muito alta. Na verdade, os eletrodos negativo (metal de lítio) e positivo (ar ou oxigênio) são as razões pelas quais, respectivamente, as baterias recarregáveis de metal de lítio não chegaram ao mercado na década de 1970 (a bateria de íon de lítio em um dispositivo móvel usa um Composto de grafita LiC 6 no eletrodo negativo, não um metal de lítio). No entanto, devido à percepção da falta de outras alternativas para baterias recarregáveis de alta energia específica e devido a alguns resultados inicialmente promissores de laboratórios acadêmicos, tanto o número de patentes quanto de publicações de domínio livre relacionadas ao lítio-oxigênio (incluindo Li-ar) as baterias começaram a crescer exponencialmente em 2006. No entanto, as dificuldades técnicas enfrentadas por essas baterias, especialmente os tempos de recarga, a sensibilidade ao nitrogênio e à água e a baixa condutividade intrínseca das espécies carregadas de Li 2 O 2 são os maiores desafios.
Design e operação
Em geral, os íons de lítio se movem entre o ânodo e o cátodo através do eletrólito. Sob descarga, os elétrons seguem o circuito externo para fazer trabalho elétrico e os íons de lítio migram para o cátodo. Durante a carga, as placas de metal de lítio no ânodo, liberando O
2 no cátodo. Ambos não-aquosa (com Li 2 O 2 ou LiO 2 como os produtos de descarga) e aquosa (LiOH como o produto de descarga) LiO 2 baterias têm sido consideradas. A bateria aquosa requer uma camada protetora no eletrodo negativo para evitar que o metal Li reaja com a água.
Ânodo
O metal de lítio é a escolha típica do ânodo. No ânodo, o potencial eletroquímico força o metal de lítio a liberar elétrons por oxidação (sem envolver o oxigênio catódico). A meia-reação é:
- Li ⇌ Li + + e -
O lítio tem alta capacidade específica (3840 mAh / g) em comparação com outros materiais de bateria de metal-ar (820 mAh / g para zinco, 2965 mAh / g para alumínio ). Vários problemas afetam essas células. O principal desafio no desenvolvimento do ânodo é evitar que o ânodo reaja com o eletrólito. As alternativas incluem novos materiais eletrolíticos ou redesenho da interface entre o eletrólito e o ânodo. Os ânodos de lítio podem causar depósitos dendríticos de lítio, diminuindo a capacidade de energia ou provocando um curto-circuito . Os efeitos do tamanho dos poros e da distribuição do tamanho dos poros permanecem mal compreendidos.
Ao carregar / descarregar em células apróticas, camadas de sais de lítio precipitam no ânodo, eventualmente cobrindo-o e criando uma barreira entre o lítio e o eletrólito. Esta barreira previne inicialmente a corrosão, mas eventualmente inibe a cinética de reação entre o ânodo e o eletrólito. Esta mudança química da interface sólido-eletrólito (SEI) resulta na variação da composição química em toda a superfície, fazendo com que a corrente varie de acordo. A distribuição de corrente desigual favorece o crescimento de dendrito ramificado e normalmente leva a um curto-circuito entre o ânodo e o cátodo.
Em células aquosas, os problemas no SEI decorrem da alta reatividade do metal lítio com a água.
Várias abordagens tentam superar esses problemas:
- Formação de uma camada protetora de íons de lítio usando eletrólitos de copolímero di e tribloco . De acordo com a Seeo, Inc., tais eletrólitos (por exemplo, poliestireno com alta condutividade de íons de lítio de um segmento de polímero macio, como um poli (óxido de etileno (PEO) e mistura de sal de lítio)) combinam a estabilidade mecânica de um segmento de polímero com a alta condutividade iônica da mistura de polímero macio-sal de lítio. A dureza inibe curtos dendríticos por meio de bloqueio mecânico.
- O vidro condutor de íons de lítio ou materiais vitrocerâmicos são (geralmente) prontamente reduzidos pelo metal de lítio e, portanto, uma película fina de um material condutor de lítio estável, como o Li
3 P ou Li
3 N , pode ser inserido entre a cerâmica e o metal. Este SEI baseado em cerâmica inibe a formação de dendritos e protege o metal de lítio da contaminação atmosférica.
Cátodo
No cátodo, durante a carga, o oxigênio doa elétrons para o lítio por meio de redução. O carbono mesoporoso tem sido usado como substrato catódico com catalisadores metálicos que aumentam a cinética de redução e aumentam a capacidade específica do catodo. Manganês, cobalto, rutênio, platina, prata ou uma mistura de cobalto e manganês são potenciais catalisadores de metal. Em algumas circunstâncias, os catodos catalisados por manganês tiveram o melhor desempenho, com uma capacidade específica de 3137 mA · H / g de carbono e os catodos catalisados por cobalto tiveram o segundo melhor desempenho, com uma capacidade específica de 2.414 mA · H / g de carbono. Com base na primeira modelagem em escala de poro de baterias de lítio-ar, a microestrutura do cátodo afeta significativamente a capacidade da bateria em regimes de não bloqueio e bloqueio de poro.
A maioria dos limites da bateria de lítio está no cátodo, que também é a fonte de suas vantagens potenciais. O oxigênio atmosférico deve estar presente no cátodo, mas contaminantes como o vapor de água podem danificá-lo. A descarga incompleta devido ao bloqueio do cátodo de carbono poroso com produtos de descarga, como peróxido de lítio (em designs apróticos) é a mais séria.
Os catalisadores têm se mostrado promissores na criação de nucleação preferencial de Li
2 O
2 sobre Li
2 O , que é irreversível em relação ao lítio.
O desempenho do ar lítio é limitado pela eficiência da reação no cátodo, porque a maior parte da queda de tensão ocorre lá. Vários produtos químicos foram avaliados, diferenciados por seus eletrólitos. Esta discussão se concentra em eletrólitos apróticos e aquosos, visto que a eletroquímica de estado sólido é pouco compreendida.
Em uma célula com eletrólito aprótico, os óxidos de lítio são produzidos por redução no cátodo:
- Li + + e - + O
2 + * → LiO
2 * - Li + + e - + LiO
2 * → Li
2 O
2 *
onde "*" denota um site de superfície em Li
2 O
2 em que os rendimentos de crescimento, que é essencialmente uma vaga Li neutro no Li
2 O
2 superfície.
Os óxidos de lítio são insolúveis em eletrólitos apróticos, o que leva ao entupimento do cátodo.
A MnO
2 O catodo da matriz de nanofios ampliado por um vírus bacteriófago M13 geneticamente modificado oferece duas a três vezes a densidade de energia das baterias de íons de lítio da era 2015. O vírus aumentou o tamanho da matriz de nanofios, que tem cerca de 80 nm de diâmetro. Os fios resultantes tinham uma superfície pontiaguda. Picos criam mais área de superfície para hospedar locais de reação. O processo viral cria uma estrutura 3D reticulada, em vez de fios isolados, estabilizando o eletrodo. O processo viral é à base de água e ocorre em temperatura ambiente.
Eletrólito
Os esforços em baterias de ar de lítio concentraram-se em quatro eletrólitos: ácido aquoso, alcalino aquoso, prótico não aquoso e aprótico.
Em uma célula com um eletrólito aquoso, a redução no cátodo também pode produzir hidróxido de lítio:
Aquoso
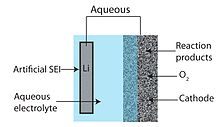
Uma bateria de Li-ar aquosa consiste em um ânodo de metal de lítio, um eletrólito aquoso e um cátodo de carbono poroso. O eletrólito aquoso combina sais de lítio dissolvidos em água. Isso evita o problema de entupimento do cátodo porque os produtos da reação são solúveis em água. O projeto aquoso tem um potencial de descarga prático mais alto do que sua contraparte aprótica. No entanto, o metal de lítio reage violentamente com a água e, portanto, o projeto aquoso requer uma interface de eletrólito sólido entre o lítio e o eletrólito. Normalmente, uma cerâmica ou vidro condutor de lítio é usado, mas a condutividade é geralmente baixa (na ordem de 10-3 S / cm em temperatura ambiente).
Eletrólito ácido
- 2Li + ½ O
2 + 2H + → 2Li + + H
2 O
Uma base conjugada está envolvida na reação. A energia específica máxima teórica da célula de Li-ar e a densidade de energia são 1400 W · h / kg e 1680 W · h / l, respectivamente.
Eletrólito aquoso alcalino
- 2Li + ½ O
2 + H
2 O → 2LiOH
As moléculas de água estão envolvidas nas reações redox no cátodo do ar. A energia específica máxima teórica da célula de Li-ar e a densidade de energia são 1300 W · h / kg e 1520 W · h / l, respectivamente.
Novos materiais catódicos devem ser responsáveis pela acomodação de quantidades substanciais de LiO
2 , Li
2 O
2 e / ou LiOH sem causar o bloqueio dos poros catódicos e empregar catalisadores adequados para tornar as reações eletroquímicas energeticamente práticas.
- Os materiais do sistema de poro duplo oferecem a capacidade de energia mais promissora.
- O primeiro sistema de poros serve como depósito de produtos de oxidação.
- O segundo sistema de poros serve como transporte de oxigênio.
Aprótico
As baterias de ar de lítio não aquosas foram demonstradas primeiro. Eles geralmente usam solventes mistos de carbonato de etileno + carbonato de propileno com LiPF 6 ou sais de bis-sulfonimida de Li como baterias de íon de lítio convencionais, no entanto, com um eletrólito gelificado em vez de líquido. A diferença de tensão na carga e descarga de corrente constante é geralmente entre 1,3 e 1,8 V (com um OCP de cerca de 4,2 V), mesmo em correntes ridiculamente baixas como 0,01-0,5 mA / cm² e 50-500 mA / g de C no eletrodo positivo (veja a Figura 2), entretanto, os solventes carbonáticos evaporam e são oxidados devido a uma alta sobretensão na carga. Outros solventes, como glimas terminadas, DMSO, dimetilacetamida e líquidos iônicos, foram considerados. O cátodo de carbono é oxidado acima de +3,5 V v Li durante a carga, formando Li 2 CO 3 , o que leva a uma perda de capacidade irreversível.
A maior parte do esforço envolveu materiais apróticos , que consistem em um ânodo de metal de lítio, um eletrólito orgânico líquido e um cátodo de carbono poroso. O eletrólito pode ser feito de qualquer líquido orgânico capaz de solvatar sais de lítio, como LiPF
6 , LiAsF
6 , LiN (SO
2 CF
3 )
2 e LiSO
3 CF
3 ), mas normalmente consiste em carbonatos , éteres e ésteres . O cátodo de carbono é geralmente feito de um material de carbono de alta área superficial com um catalisador de óxido de metal nanoestruturado (comumente MnO
2 ou Mn
3 O
4 ) Uma grande vantagem é a formação espontânea de uma barreira entre o ânodo e o eletrólito (análoga à barreira formada entre o eletrólito e os ânodos de carbono-lítio em baterias de íon-lítio convencionais) que protege o metal de lítio de uma reação posterior com o eletrólito. Embora recarregável, o Li
2 O
2 produzido no cátodo é geralmente insolúvel no eletrólito orgânico, levando ao acúmulo ao longo da interface cátodo / eletrólito. Isso torna os cátodos em baterias apróticas sujeitos a entupimento e expansão de volume, o que reduz progressivamente a condutividade e degrada o desempenho da bateria. Outro problema é que os eletrólitos orgânicos são inflamáveis e podem pegar fogo se a célula for danificada.
Embora a maioria dos estudos concorde que Li
2 O
2 é o produto final da descarga de baterias não aquosas de Li-O 2 , evidência considerável de que sua formação não ocorre como uma eletrorredução direta de 2 elétrons em peróxido O 2−
2 (que é o caminho comum para a redução de O 2 na água sobre o carbono), mas sim através de uma redução de um elétron para superóxido O -
2 , seguido por sua desproporção:
-
2 LiO
2 ⇌ Li
2 O
2 + O
2( 1 )
Superóxido (O -
2 ) tem sido tradicionalmente considerado um intermediário perigoso em baterias de oxigênio aprótico devido à sua alta nucleofilicidade , basicidade e potencial redox. No entanto, relatórios sugerem que LiO 2 é um intermediário durante a descarga de peróxido ( Li
2 O
2 ) e pode ser usado como produto de descarga final, potencialmente com um ciclo de vida melhorado, embora com uma energia específica mais baixa (bateria um pouco mais pesada). Na verdade, foi mostrado que sob certas condições, o superóxido pode ser estável na escala de 20-70 h à temperatura ambiente. Uma perda de capacidade irreversível devido à desproporção de LiO 2 na bateria carregada não foi resolvida.
Pt / C parece ser o melhor eletrocatalisador para evolução de O 2 e Au / C para redução de O 2 quando Li
2 O
2 é o produto. No entanto, "o desempenho das baterias de lítio-ar recarregáveis com electrólitos não-aquosas é limitada pelas reacções no eléctrodo de oxigénio, especialmente por O 2 evolução. Eléctrodos de ar de carbono poroso convencionais são incapazes de fornecer mAh / g e mAh / cm 2 capacidades e taxas de descarga nas magnitudes necessárias para baterias de densidade de energia realmente alta para aplicações EV. " A capacidade (em mAh / cm 2 ) e o ciclo de vida das baterias de Li-O 2 não aquosas são limitadas pela deposição de fases de LiOx insolúveis e com pouca condução eletrônica após a descarga. ( Li
3 O
4 é previsto ter uma melhor condutividade de Li + do que LiO 2 e Li
2 O
2 fases). Isso torna a energia específica prática das baterias de Li-O 2 significativamente menor do que o cálculo do nível de reagente prevê. Parece que esses parâmetros atingiram seus limites, e melhorias adicionais são esperadas apenas com métodos alternativos.
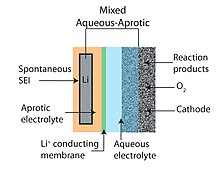
Misto aquoso-aprótico
O projeto de bateria de lítio-ar aquoso-aprótico ou misto tenta unir as vantagens dos projetos de bateria aprótica e aquosa. A característica comum dos designs híbridos é um eletrólito de duas partes (uma parte aquosa e uma parte aprótica) conectado por uma membrana condutora de lítio . O ânodo confina com o lado aprótico enquanto o cátodo está em contato com o lado aquoso. Uma cerâmica condutora de lítio é normalmente empregada como a membrana que une os dois eletrólitos.
O uso de um eletrólito sólido (ver Fig. 3) é uma das abordagens alternativas que permite a combinação de um ânodo de metal de lítio com um cátodo aquoso. Eletrólitos sólidos cerâmicos (CSEs) da família NASICON (por exemplo, Li 1 − x A x M 2 − x (PO 4 ) 3 com A ∈ [Al, Sc, Y] e M ∈ [Ti, Ge]) foram estudados . Compatível com água em pH alcalino e tendo uma grande janela eletroquímica (ver Figs. 3,4), sua baixa condutividade de íons Li + próxima à temperatura ambiente (<0,005 S / cm,> 85 Ω cm 2 ) os torna inadequados para energia automotiva e estacionária aplicativos de armazenamento que exigem baixo custo (ou seja, densidades de corrente operacional acima de 100 mA / cm 2 ). Além disso, tanto Ti quanto Ge são reduzidos por Li metálico, e uma camada intermediária entre o eletrodo de cerâmica e o eletrodo negativo é necessária. Em contraste, eletrólitos de polímero sólido (SPEs) podem fornecer uma condutividade mais alta às custas de um cruzamento mais rápido de água e de outras moléculas pequenas que são reativas com Li metálico. Entre as membranas mais exóticas consideradas para baterias de Li-O 2 está o silício de cristal único.
Em 2015, os pesquisadores anunciaram um projeto que usava grafeno altamente poroso para o ânodo, um eletrólito de bis (trifluorometil) sulfonilimida / dimetoxietano de lítio com adição de água e iodeto de lítio para uso como "mediador". O eletrólito produz hidróxido de lítio (LiOH) no cátodo em vez de peróxido de lítio ( Li
2 O
2 ) O resultado ofereceu eficiência energética de 93 por cento (diferença de tensão de 0,2) e ciclou mais de 2.000 vezes com pouco impacto na produção. No entanto, o projeto exigia oxigênio puro, em vez de ar ambiente.
Estado sólido
O design de uma bateria de estado sólido é atraente por sua segurança, eliminando a chance de ignição por ruptura. As baterias de lítio-ar de estado sólido atuais usam um ânodo de lítio, um eletrólito de cerâmica, vidro ou vitrocerâmica e um cátodo de carbono poroso. O ânodo e o cátodo são normalmente separados do eletrólito por compósitos de polímero-cerâmica que aumentam a transferência de carga no ânodo e acoplam eletroquimicamente o cátodo ao eletrólito. Os compostos de polímero-cerâmica reduzem a impedância geral. A principal desvantagem do projeto da bateria de estado sólido é a baixa condutividade da maioria dos eletrólitos de vitrocerâmica. A condutividade iônica dos atuais condutores de íons rápidos de lítio é menor do que as alternativas de eletrólito líquido.
Desafios
A partir de 2013, muitos desafios enfrentaram os designers.
Cátodo
A maioria dos limites da bateria de lítio-ar está no cátodo, que também é a fonte de suas vantagens potenciais. A descarga incompleta devido ao bloqueio do cátodo de carbono poroso com produtos de descarga, como peróxido de lítio (em designs apróticos) é a mais séria. Vários modos de precipitados foram modelados. Um parâmetro, Da, foi definido para medir as variações de temperatura, concentração de espécies e potenciais.
Os efeitos do tamanho dos poros e distribuição do tamanho dos poros permanecem mal compreendidos.
Os catalisadores têm se mostrado promissores na criação de nucleação preferencial de Li
2 O
2 sobre Li
2 O , que é irreversível em relação ao lítio.
O oxigênio atmosférico deve estar presente no cátodo, mas contaminantes como o vapor de água podem danificá-lo.
Eletroquímica
Em projetos de células de 2017, o superpotencial de carga é muito maior do que o superpotencial de descarga. Um excesso de potencial de carga significativo indica a presença de reações secundárias. Assim, a eficiência elétrica é de apenas cerca de 65%.
Catalisadores como MnO
2 , Co, Pt e Au podem reduzir potencialmente os sobrepotenciais , mas o efeito é mal compreendido. Vários catalisadores melhoram o desempenho do cátodo, notavelmente MnO
2 , e o mecanismo de melhoria é conhecido como redox de superfície de oxigênio, fornecendo abundantes locais de crescimento inicial para o peróxido de lítio. Também é relatado que os catalisadores podem alterar a estrutura dos depósitos de óxidos.
Quedas significativas na capacidade da célula com o aumento das taxas de descarga são outro problema. A diminuição na capacidade da célula é atribuída aos limites de transferência de carga cinética. Como a reação anódica ocorre muito rapidamente, acredita-se que os limites de transferência de carga ocorram no cátodo.
Estabilidade
A operação de bateria de longo prazo requer estabilidade química de todos os componentes da célula. Projetos de células atuais mostram baixa resistência à oxidação por produtos de reação e intermediários. Muitos eletrólitos aquosos são voláteis e podem evaporar com o tempo. A estabilidade é geralmente prejudicada por reações químicas parasitárias, por exemplo, aquelas envolvendo oxigênio reativo .
Formulários
Veículos
As células de lítio-ar são de interesse para veículos elétricos, por causa de sua alta densidade de energia volumétrica e específica teórica, comparável à gasolina . Os motores elétricos fornecem alta eficiência (95% em comparação com 35% para um motor de combustão interna ). As células de ar de lítio poderiam oferecer alcance equivalente aos veículos de hoje com uma bateria com um terço do tamanho dos tanques de combustível padrão, supondo que o equilíbrio da planta necessário para manter a bateria fosse de massa ou volume insignificante.
Backup de grade
Em 2014, os pesquisadores anunciaram uma bateria de célula solar híbrida. Até 20% da energia produzida por células solares convencionais é perdida ao se deslocar e carregar uma bateria. O híbrido armazena quase 100% da energia produzida. Uma versão do híbrido usava uma bateria de íon de potássio usando potássio-ar. Oferecia maior densidade de energia do que as baterias convencionais de íon-lítio, custava menos e evitava subprodutos tóxicos. O dispositivo mais recente substituiu essencialmente o potássio pelo lítio.
A célula solar usava uma malha feita de hastes microscópicas de dióxido de titânio para permitir a passagem do oxigênio necessário. A luz solar capturada produziu elétrons que decompõem o peróxido de lítio em íons de lítio, carregando assim a bateria. Durante a descarga, o oxigênio do ar reabasteceu o peróxido de lítio.
Veja também
Referências
links externos
- Argonne abre capítulo na pesquisa de baterias - ar de lítio
- Pesquisa avançada de baterias da Argonne, orientada para substituir a gasolina
- O Projeto IBM Battery 500
- Empresa de baterias PolyPlus
- Lithion, Inc. Projeto de bateria de ar de lítio
- Químicos fazem avanços na criação de uma bateria recarregável de lítio-oxigênio , University of Waterloo
- Uma bateria recarregável de lítio-oxigênio de estado quase sólido baseada em um eletrólito de polímero em gel com um líquido iônico.