Tetrafluoreto de tionila - Thionyl tetrafluoride

|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Tetrafluoreto de tionil
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
|
PubChem CID
|
|||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| SOF 4 | |||
| Aparência | gás incolor | ||
| Densidade | 1.653−0.0036T (° C) líquido | ||
| Ponto de fusão | −99,6 ° C (−147,3 ° F; 173,6 K) | ||
| Ponto de ebulição | −49 ° C (−56 ° F; 224 K) 5090 cal / mol calor de vaporização | ||
| reação na água | |||
| log P | 7,2349−859,58 / T − 26275 / T² | ||
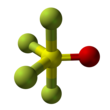
| Estrutura | |||
| bipiramide trigonal distorcida | |||
| Perigos | |||
| Frases R (desatualizado) | R36 / 37/38 | ||
| Compostos relacionados | |||
|
Oxohalides relacionados
|
Fluoreto de tionila Selenil tetrafluoreto |
||
|
Compostos relacionados
|
Fosforil trifluoreto pentafluorosulfur hipofluorito sulfuril fluoreto |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais no estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O tetrafluoreto de tionila é um gás composto inorgânico com a fórmula S O F 4 . É também conhecido como óxido de tetrafluoreto de enxofre . A forma da molécula é uma bipirâmide trigonal distorcida, com o oxigênio encontrado no equador. Os átomos no equador têm comprimentos de ligação mais curtos do que os átomos de flúor no eixo. A ligação enxofre ao oxigênio é 1,409Å. A ligação AS-F no eixo tem comprimento 1,596Å e a ligação S-F no equador tem comprimento 1,539Å. O ângulo entre os átomos de flúor equatorial é 112,8 °. O ângulo entre o flúor axial e o oxigênio é de 97,7 °. O ângulo entre o oxigênio e o flúor equatorial é 123,6 ° e entre o flúor axial e equatorial é 85,7 °. Os átomos de flúor produzem apenas uma linha de RMN , provavelmente porque trocam de posição .
Formação
O fluoreto de tionila que reage com o gás flúor pode produzir tetrafluoreto de tionila. Foi assim que o gás foi descoberto por Moissan e Lebeau em 1902. Eles identificaram a fórmula pelas mudanças de pressão resultantes da reação. O fluoreto de prata e a platina são capazes de catalisar a reação.
Também pode ser formado aquecendo o hexafluoreto de enxofre com ar a 400 °. Isso pode acontecer ao inalar através de um cigarro aceso. Ou a reação do difluoreto de prata com o fluoreto de tionila a 200 graus. Outra forma de formá-lo é eletrolizando o fluoreto de hidrogênio com uma solução de dióxido de enxofre , que também produz difluoreto de oxigênio e fluoreto de sulfurila . Além disso, o cloreto de tionila ou o fluoreto de tionila eletrolisado com fluoreto de hidrogênio produziam ainda mais do gás.
Reações
O tetrafluoreto de tionila reage com a água para formar ácido fluorídrico , ácido sulfurofluorídico e difluoreto de sulfurila . O mercúrio pode remover o flúor para formar o fluoreto de tionila e o fluoreto de mercúrio . Bases fortes resultam na formação de íons fluoreto e fluorossulfato .
Química do clique
O tetrafluoreto de tionila pode ser usado na química do clique por meio de reações com aminas primárias conhecidas como troca de fluoreto de enxofre (VI) (SuFEx). Esse tipo de reação foi a primeira reação de "clique" para gerar um núcleo tridimensional.
Referências
- ^ a b c d e f Harry Julius Emeléus e AG Sharpe Advances in Inorganic Chemistry Volume 2 Academic Press 1960 página 117 [1]
- ^ "Dados de segurança (MSDS) para tetrafluoreto de tionila" . Universidade de Oxford. 02-09-2005 . Página visitada em 29/07/2008 .
- ^ Lise Hedberg e Kenneth Hedberg "Thionyl tetrafluoride. Reanalysis of the molecular structure and resolution of the multiple model problem" the Journal of Physical Chemistry Março 1982 vol 86 página 598 doi 10.1021 / j100394a004 [2]
- ^ "Propriedades do gás SF6" .
- ^ Dudley, FB (1956). "Pentafluorosulfur Hypofluorite and Thionyl Tetrafluoride". Journal of the American Chemical Society . 78 (8): 1553–1557. doi : 10.1021 / ja01589a013 .
- ^ Shunji Nagase Fluorination of Inorganic Sulphur Compounds Bulletin da Chemical Society of Japan vol. 42, página 2062, 1968
- ^ Li, Suhua; Wu, Peng; Moses, John E .; Sharpless, K. Barry (01/02/2017). "Multidimensional SuFEx Click Chemistry: Sequential Sulphur (VI) Fluoride Exchange Connections of Diverse Modules Launch From an SOF4 Hub" . Angewandte Chemie International Edition . 56 (11): 2903–2908. doi : 10.1002 / anie.201611048 . ISSN 1521-3773 . PMC 5434761 . PMID 28165188 .