Química anfitrião-convidado - Host–guest chemistry
Na química supramolecular , a química hospedeiro-hóspede descreve complexos que são compostos de duas ou mais moléculas ou íons que são mantidos juntos em relações estruturais únicas por forças diferentes daquelas das ligações covalentes completas . A química hospedeiro-hóspede engloba a ideia de reconhecimento molecular e interações por meio de ligações não covalentes . A ligação não covalente é crítica na manutenção da estrutura 3D de moléculas grandes, como proteínas, e está envolvida em muitos processos biológicos nos quais moléculas grandes se ligam especificamente, mas de forma transitória, umas às outras.
Embora as interações não covalentes possam ser aproximadamente divididas naquelas com contribuições mais eletrostáticas ou dispersivas, existem poucos tipos comumente mencionados de interações não covalentes: ligações iônicas , ligações de hidrogênio , forças de van der Waals e interações hidrofóbicas .


Visão geral
A química hospedeiro-hóspede é um ramo da química supramolecular em que uma molécula hospedeira forma um composto químico com uma molécula hóspede ou íon. Os dois componentes do composto são mantidos juntos por forças não covalentes, mais comumente por ligações de hidrogênio . A ligação entre o hospedeiro e o convidado é geralmente altamente específica para as duas metades envolvidas. A formação desses complexos é central para o tema do reconhecimento molecular .
Há um equilíbrio entre o estado desvinculado, no qual host e convidado estão separados um do outro, e o estado vinculado, no qual há um complexo host-convidado estruturalmente definido:
- H = "host", G = "convidado", HG = "complexo host-convidado"
O componente "hospedeiro" pode ser considerado a molécula maior e engloba a molécula "hóspede" menor. Em sistemas biológicos, os termos análogos de hospedeiro e hóspede são comumente referidos como enzima e substrato, respectivamente.
Para projetar sistemas sintéticos que realizam funções e tarefas específicas, é muito importante entender a termodinâmica da ligação entre o host e o convidado. Os químicos estão se concentrando na troca de energia de diferentes interações de ligação e tentando desenvolver experimentos científicos para quantificar as origens fundamentais dessas interações não covalentes, utilizando várias técnicas, como espectroscopia de RMN, espectroscopia de UV / visível e calorimetria de titulação isotérmica. A análise quantitativa dos valores das constantes de ligação fornece informações termodinâmicas úteis.
Princípios termodinâmicos das interações hospedeiro-convidado
Os benefícios termodinâmicos da química hospedeiro-convidado são derivados da ideia de que existe uma menor energia livre de Gibbs geral devido à interação entre as moléculas hospedeiras e hóspedes. Os químicos estão tentando exaustivamente medir a energia e as propriedades termodinâmicas dessas interações não covalentes encontradas em toda a química supramolecular; e, ao fazer isso, espero obter mais informações sobre o resultado combinatório dessas muitas forças pequenas e não covalentes que são usadas para gerar um efeito geral na estrutura supramolecular.
Uma constante de associação , pode ser definida pela expressão
onde {HG} é a atividade termodinâmica do complexo em equilíbrio. {H} representa a atividade do anfitrião e {G} a atividade do convidado. As quantidades , e são as concentrações correspondentes e é um quociente dos coeficientes de atividade .
Na prática, a constante de equilíbrio é geralmente definida em termos de concentrações.
Quando esta definição é usada, está implícito que o quociente dos coeficientes de atividade tem um valor numérico de um. Em seguida, parece que a constante de equilíbrio, tem a dimensão 1 / concentração, mas que não pode ser verdade uma vez que a variação de energia livre de Gibbs padrão, é proporcional ao logaritmo da K .
Este aparente paradoxo é resolvido quando a dimensão de é definida como sendo o recíproco da dimensão do quociente de concentrações. A implicação é que é considerado como tendo um valor constante em todas as condições experimentais relevantes. No entanto, é prática comum atribuir uma dimensão, como milimole por litro ou micromole por litro, a um valor de K que foi determinado experimentalmente.
Um valor Grande indica que as moléculas do hospedeiro e do convidado interagem fortemente para formar o complexo hospedeiro-convidado.
Determinação dos valores da constante de ligação
Complexação simples hospedeiro-convidado
Quando as moléculas hospedeiras e convidadas se combinam para formar um único complexo, o equilíbrio é representado como
e a constante de equilíbrio, K, é definida como
onde [X] denota a concentração de uma espécie química X (todos os coeficientes de atividade são considerados como tendo valores numéricos de 1). As equações de balanço de massa, em qualquer ponto de dados,
onde e representam as concentrações totais, de hospedeiro e convidado, podem ser reduzidas a uma única equação quadrática em, digamos, [G] e, portanto, podem ser resolvidas analiticamente para qualquer dado valor de K. As concentrações [H] e [HG] podem então derivado.
A próxima etapa do cálculo é calcular o valor ,, de uma quantidade correspondente à quantidade observada . Então, uma soma de quadrados, U, sobre todos os pontos de dados, np, pode ser definida como
e isso pode ser minimizado em relação ao valor da constante de estabilidade, K, e um parâmetro como o deslocamento químico da espécie HG (dados nmr) ou sua absorvência molar (dados uv / vis). A minimização pode ser realizada em um aplicativo de planilha, como o EXCEL , usando o utilitário SOLVER embutido.
Este procedimento deve ser usado somente quando for certo que o aduto 1: 1 é a única espécie complexa formada. Uma simples verificação da validade desta afirmação é que os resíduos devem apresentar uma distribuição aleatória ; caso contrário, a formação de uma segunda espécie deve ser considerada, usando os métodos da seção seguinte.
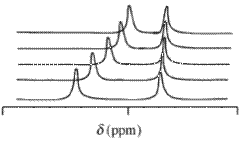
Dados de ressonância magnética nuclear (NMR)
Com espectros de ressonância magnética nuclear (NMR), o valor de deslocamento químico observado , δ , decorrente de um determinado átomo contido em uma molécula de reagente e um ou mais complexos desse reagente, será a média ponderada da concentração de todos os deslocamentos dessas espécies químicas. A troca química é considerada rápida na escala de tempo de NMR. termos de frações molares ,
é o deslocamento químico da i- ésima espécie química que contém o núcleo e é a concentração / fração molar ( c é uma concentração / mol dm -3 ) dessa espécie. Essa expressão tem a mesma forma matemática da lei de Beer . Os valores de deslocamento químico podem ser obtidos para mais de um núcleo de uma maneira análoga que a absorbância pode ser medida em mais de um comprimento de onda. Os isótopos típicos que podem ser usados neste contexto são 1 H, 13 C e 31 P. É comum usar um solvente deuterado ao medir os valores de desvio químico de 1 H.
Dados de absorção
Supõe-se que a absorbância de cada espécie é proporcional à concentração daquela espécie, de acordo com a lei de Beer-Lambert .
onde λ é um comprimento de onda, é o comprimento do caminho óptico da cubeta que contém a solução dos N compostos ( cromóforos ), é a absorbância molar (também conhecida como coeficiente de extinção) da i- ésima espécie química no comprimento de onda λ, c i é sua concentração. Quando as concentrações foram calculadas como acima e a absorbância foi medida para amostras com várias concentrações de hospedeiro e convidado, a lei de Beer-Lambert fornece um conjunto de equações, em um determinado comprimento de onda, que pode ser resolvido por mínimos quadrados lineares processo para os valores de coeficiente de extinção desconhecidos naquele comprimento de onda.
Dados de fluorescência
O tratamento deste tipo de dados é semelhante ao tratamento dos dados de absorbância. Na verdade, a equação que define a relação entre a intensidade da fluorescência e as concentrações das espécies é muito semelhante.
onde é a intensidade fluorescente da i-ésima espécie na concentração unitária.
Calorimetria
O calor desenvolvido quando uma alíquota de solução hospedeira é adicionada a uma solução contendo o hóspede é a soma das contribuições de cada reação
em que é um valor de mudança de calor medido (corrigida para todas as contribuições de calor externos) no ponto de dados j , é a quantidade de calor absorvido ou emitido quando uma mole de o i th produto de reacção é formada e é a alteração real do número de moles de esse produto naquele ponto de dados. é calculado resolvendo as equações de equilíbrio de massa com valores dados das constantes de equilíbrio. Se os valores da constante de equilíbrio são conhecidos, a mudança de entalpia padrão pode ser calculada por um processo de mínimos quadrados lineares, caso contrário, um método não linear de ajuste de dados deve ser usado.
A calorimetria de titulação isotérmica é comumente usada para determinar os valores de uma constante de equilíbrio e a entalpia de reação padrão correspondente. Os fabricantes de instrumentos ITC fornecem algum software com o qual essas quantidades podem ser obtidas a partir de valores de dados experimentais.
Reação de complexação geral
Para cada equilíbrio envolvendo um hospedeiro, H e um convidado G
a constante de equilíbrio,, é definida como
Os valores das concentrações livres e são obtidos resolvendo as equações de balanço de massa com valores conhecidos ou estimados para as constantes de estabilidade.
Então, as concentrações de cada espécie complexa também podem ser calculadas como . A relação entre a concentração de uma espécie e a quantidade medida é específica para a técnica de medição, conforme indicado em cada seção acima. Usando essa relação, o conjunto de parâmetros, os valores da constante de estabilidade e os valores das propriedades, como absortividade molar ou deslocamentos químicos especificados, podem ser refinados por um processo de refinamento de mínimos quadrados não linear . Para uma exposição mais detalhada da teoria, consulte Determinação das constantes de equilíbrio . Alguns programas de computador dedicados estão listados em Implementações .
Determinação de entalpia padrão e valores de mudança de entropia
Considere, primeiro, o sistema onde uma solução contém certas quantidades de um hospedeiro, H , e um hóspede, G , em equilíbrio com o único complexo HG .
Agora, suponha que uma pequena quantidade de convidado seja adicionada a uma mistura de anfitrião e convidado em equilíbrio. Um novo equilíbrio será então estabelecido e uma quantidade de calor, Q , será desenvolvida. Quando essa quantidade foi medida e corrigida para fatores instrumentais, ela está relacionada à mudança na quantidade de HG complexo que está presente na solução.
onde Δ H ⊖ é a entalpia padrão de formação , ou seja, a entalpia para a formação de 1 mol do complexo, HG e é a variação do número de moles da espécie HG em solução.
Se o valor da constante de equilíbrio,, for conhecido, a quantidade pode ser calculada resolvendo as equações de equilíbrio de massa antes e depois da adição (consulte # Complexação simples host-convidado , acima). Em seguida, o valor de Δ H ⊖ pode ser obtida utilizando o método de mínimos quadrados linear encaixe com uma série de valores experimentais de Q .
Se o valor de K não for conhecido, um refinamento de mínimos quadrados não linear deve ser executado para obter os dois parâmetros, e . Quando os dados são obtidos usando uma calorimetria de titulação isotérmica, o software necessário para os cálculos é fornecido pelo fabricante do instrumento.
Observação: o uso da equação de van 't Hoff para calcular a alteração de entalpia padrão está obsoleto porque o valor obtido por meio desse método pode estar sujeito a erros excessivos .
Em geral, quando m complexos são formados, o calor desenvolvido no k- ésimo ponto de "titulação" é a soma das contribuições resultantes de uma mudança na concentração de um produto de reação.
Existem 2 m de parâmetros a serem determinados, uma mudança de entalpia padrão e uma constante de equilíbrio para a formação de cada produto de reação. Os fabricantes de instrumentos ITC fornecem alguns produtos de software específicos com os quais vários valores de parâmetros podem ser calculados. Programas de computador para o caso geral, como HypΔH . Afinímetro ITC também está disponível.
Quando os valores de cada mudança de entalpia padrão e constante de equilíbrio foram determinados, o valor da mudança de entropia padrão correspondente pode ser derivado da expressão
a uma dada temperatura, T .
Técnicas experimentais
Ressonância magnética nuclear
A ressonância magnética nuclear (NMR) é uma das técnicas espectroscópicas mais poderosas em química analítica. É uma importante ferramenta para o estudo de complexos hospedeiro-hóspede, por elucidar as estruturas dos diversos complexos existentes na forma de agregados, pares iônicos ou sistemas encapsulados. Como o nome sugere, o NMR identifica os diferentes núcleos nas moléculas (mais comumente, prótons ), medindo seu deslocamento químico . A atividade de ligação de duas moléculas causa uma mudança considerável em seus ambientes eletrônicos. Isso leva a uma mudança nos sinais no espectro de RMN, e esse princípio básico é usado para estudar os fenômenos da química hospedeiro-hóspede. As forças motrizes para a ligação hospedeiro-convidado são as várias interações secundárias entre as moléculas, como ligações de hidrogênio e interação pi-pi . Assim, NMR também serve como uma técnica importante para estabelecer a presença dessas interações em um complexo hospedeiro-convidado.
Estudos anteriores de NMR forneceram informações úteis sobre a ligação de diferentes hóspedes aos hospedeiros. Fox et al. calculou as interações de ligações de hidrogênio entre as moléculas de piridina e o dendrímero de poli (amidoamina (PAMAM) ; com base na mudança química dos grupos amina e amida . Em um estudo semelhante, Xu et al. titulou o dendrímero G4 PAMAM à base de carboxilato ( o hospedeiro) com vários medicamentos à base de amina (os convidados) e monitoraram as mudanças químicas do dendrímero. Em conjunto com as técnicas de 2D- NOESY NMR, eles foram capazes de localizar com precisão a posição dos medicamentos nos dendrímeros e o efeito da funcionalidade sobre a afinidade de ligação dos medicamentos. Eles encontraram evidências conclusivas para mostrar que as moléculas do medicamento catiônico se fixam na superfície dos dendrímeros aniônicos por interações eletrostáticas, enquanto um medicamento aniônico se localiza tanto no núcleo quanto na superfície dos dendrímeros, e que a força dessas interações são dependentes dos valores de pKa das moléculas.
Em outro estudo, Sun et al. estudaram a química hospedeiro-hóspede de moléculas de trisbipiridil-viologeno de rutênio com cucurbituril . Enquanto monitoravam a mudança nas mudanças químicas dos prótons da piridina no viologen , eles descobriram que os modos de ligação para os complexos 1: 1 são completamente diferentes para as diferentes moléculas de cucurbituril.
Um fator importante que deve ser mantido em mente ao analisar a ligação entre o host e o convidado é o tempo gasto para aquisição de dados em comparação com o tempo para o evento de ligação. Em muitos casos, os eventos de ligação são muito mais rápidos do que a escala de tempo de aquisição de dados, caso em que a saída é um sinal médio para as moléculas individuais e o complexo. A escala de tempo de NMR é da ordem de milissegundos, o que em certos casos, quando a reação de ligação é rápida, limita a precisão da técnica.
Espectroscopia ultravioleta-visível
A espectroscopia ultravioleta-visível é um dos métodos mais antigos e rápidos de estudar a atividade de ligação de várias moléculas. A absorção de luz ultravioleta ocorre em uma escala de tempo de picossegundos , portanto, os sinais individuais das espécies podem ser observados. Ao mesmo tempo, a intensidade de absorção se correlaciona diretamente com a concentração da espécie, o que permite fácil cálculo da constante de associação. Mais comumente, o hospedeiro ou o convidado são transparentes à luz ultravioleta, enquanto a outra molécula é sensível aos raios ultravioleta. A mudança na concentração das moléculas sensíveis ao UV é então monitorada e ajustada em uma linha reta usando o método Benesi-Hildebrand , a partir do qual a constante de associação pode ser calculada diretamente.
Informações adicionais sobre a estequiometria dos complexos também são obtidas, pois o método Benesi-Hilderbrand assume uma estequiometria de 1: 1 entre o hospedeiro e o hóspede. Os dados produzirão uma linha reta apenas se a formação do complexo também seguir uma estequiometria 1: 1 semelhante. Um exemplo recente de um cálculo semelhante foi feito por Sun et al., Em que titulou moléculas de trisbipiridil-viologen de rutênio com cucurbit [7] urils e representou graficamente a absorbância relativa das moléculas de cucurbit como uma função de sua concentração total em um comprimento de onda específico. Os dados se ajustaram bem a um modelo de ligação 1: 1 com uma constante de ligação de .
Como uma extensão, pode-se ajustar os dados a diferentes estequiometrias para entender a cinética dos eventos de ligação entre o hospedeiro e o convidado. fez uso deste corolário para modificar ligeiramente o gráfico de Benesi-Hilderbrand convencional para obter a ordem da reação de complexação entre o complexo salen (II) heterotrinuclear quiral com ponte de éter de bário com vários convidados imidazoles e aminoácidos metil ésteres, junto com os outros parâmetros. Eles titularam uma concentração fixa do complexo de zinco com quantidades variáveis de imidazóis e ésteres metílicos enquanto monitoravam as mudanças na absorbância da banda de transição pi-a-pi * em 368 nm. Os dados se encaixam em um modelo no qual a proporção de convidado para host é 2 no complexo. Eles ainda realizaram esses experimentos em várias temperaturas, o que lhes permitiu calcular os vários parâmetros termodinâmicos usando a equação de van 't Hoff .
Calorimetria de titulação isotérmica
Técnicas espectroscópicas dar informações sobre a constante de ligação e energia livre de Gibbs , . Para obter o conjunto completo de parâmetros termodinâmicos como e , uma análise de van 't Hoff usando a equação de van' t Hoff seria necessária. No entanto, os recentes avanços em técnicas calorimétricas permitem a medição de e em um único experimento, permitindo assim a determinação de todos os parâmetros termodinâmicos usando a equação:
desde que a experiência seja realizada em condições isotérmicas; daí o nome calorimetria isotérmica. O procedimento é semelhante a um procedimento de titulação convencional em que o hospedeiro é adicionado sequencialmente ao hóspede e o calor absorvido ou desenvolvido é medido, em comparação com uma solução em branco. O calor total liberado, Q , corresponde à constante de associação , e pela equação:
Que pode ser simplificado como
Onde
- = Concentração molar inicial do hospedeiro
- = Concentração molar do hóspede
- = volume da embarcação
A equação acima pode ser resolvida por análise de regressão não linear para obter o valor de e e subsequentemente e para aquela reação particular. As vantagens da calorimetria de titulação isotérmica sobre as outras técnicas comumente usadas, além de fornecer todo o conjunto de parâmetros termodinâmicos, são que ela é mais geral e adequada para uma ampla gama de moléculas. Não é necessário ter compostos com cromóforos ou grupos funcionais UV-visíveis para monitorar o processo de ligação, pois o sinal de calor é uma propriedade universal das reações de ligação. Ao mesmo tempo, a relação sinal-ruído é bastante favorável, o que permite uma determinação mais precisa das constantes de ligação, mesmo em condições muito diluídas. Um exemplo recente do uso dessa técnica foi o estudo da afinidade de ligação da membrana protéica em torno da Escherichia coli a cátions lipofílicos usados em drogas em vários ambientes miméticos de membrana. A motivação para o estudo acima foi que essas membranas tornam as bactérias resistentes à maioria dos compostos baseados no cátion amônio quaternário , que têm efeitos antibacterianos. Assim, uma compreensão dos fenômenos de ligação permitiria a concepção de antibióticos eficazes para E. coli . Os pesquisadores mantiveram um grande excesso do ligante sobre a proteína para permitir que a reação de ligação fosse concluída. Usando as equações acima os investigadores procederam para calcular , , e para cada droga em diferentes ambientes. Os dados indicaram que a estequiometria de ligação do fármaco com a membrana era de 1: 1 com um valor micromolar de . Os valores negativos de , e indicou que o processo foi conduzido com uma entalpia valor de 8-12 kcal / mol para cada droga.
Formulários
Espectroscopia Raman
A espectroscopia Raman é uma técnica espectroscópica usada no estudo de moléculas que exibem um efeito de espalhamento Raman quando a luz monocromática incide sobre ela. O requisito básico para obter um sinal Raman é que a luz incidente provoque uma transição eletrônica nas espécies químicas de seu estado fundamental para um estado de energia virtual, que emitirá um fóton ao retornar ao estado fundamental. A diferença de energia entre o fóton absorvido e o emitido é única para cada espécie química, dependendo de seu ambiente eletrônico. Portanto, a técnica serve como uma ferramenta importante para o estudo de vários eventos de ligação, já que a ligação entre as moléculas quase sempre resulta em uma mudança em seu ambiente eletrônico. No entanto, o que torna a espectroscopia Raman uma técnica única é que apenas as transições que são acompanhadas por uma mudança na polarização da molécula são Raman ativas. As informações estruturais derivadas dos espectros Raman fornecem informações muito específicas sobre a configuração eletrônica do complexo em comparação com as moléculas individuais hospedeiras e convidadas.
A espectroscopia Raman de fase de solução freqüentemente resulta em uma seção transversal de espalhamento fraca. Portanto, avanços recentes têm sido feitos para aprimorar os sinais Raman, como a espectroscopia Raman de superfície aprimorada e a espectroscopia de ressonância Raman . Essas técnicas têm um propósito adicional de quantificar os eventos de ligação analito-receptor, dando uma imagem mais detalhada dos fenômenos de complexação hospedeiro-hóspede onde eles realmente ocorrem, ou seja, em soluções. Em uma descoberta recente, Flood et al. determinou a força de ligação de tetratiafulvaleno (TTF) e ciclobis (paraquat-p-fenileno) usando espectroscopia Raman, bem como SERS . O trabalho anterior neste campo teve como objetivo fornecer informações sobre a ligação e a estrutura do complexo resultante, ao invés de medições quantitativas das forças de associação. Os pesquisadores tiveram que usar a espectroscopia Raman de ressonância para serem capazes de obter sinais detectáveis de soluções com concentrações tão baixas quanto 1 mM. Em particular, eles correlacionaram a intensidade das bandas Raman com a geometria do complexo no estado fotoexcitado. Semelhante à titulação baseada na espectroscopia ultravioleta-visível, eles calcularam a constante de ligação por "titulação Raman" e ajustaram as curvas de ligação a modelos 1: 1, dando um de -5,7 ± 0,6 kcal / mol. O estudo agora está fornecendo uma base para estudos semelhantes envolvendo complexos de transferência de carga em soluções.
Cooperatividade
Cooperatividade é definida como quando um ligante se liga a um receptor com mais de um local de ligação e o ligante causa uma diminuição ou aumento na afinidade para os ligantes de entrada. Se houver aumento da ligação dos ligantes subsequentes, é considerada cooperatividade positiva. Se uma diminuição da ligação for observada, então é uma cooperatividade negativa. Exemplos de cooperatividade positiva e negativa são hemoglobina e receptor de aspartato, respectivamente.
Nos últimos anos, as propriedades termodinâmicas da cooperatividade têm sido estudadas a fim de definir parâmetros matemáticos que distinguem a cooperatividade positiva ou negativa. Os tradicionais Gibbs estados equação de energia livre: . No entanto, para quantificar a cooperatividade em um sistema hospedeiro-hóspede, a energia de ligação precisa ser considerada. O esquema à direita mostra a ligação de A, ligação de B, ligação cooperativa positiva de A – B e, por último, ligação cooperativa negativa de A – B. Portanto, uma forma alternativa da equação de energia livre de Gibbs seria
Onde:
- = energia livre de ligação A
- = energia livre de ligação B
- = energia livre de ligação para A e B amarrados
- = soma das energias livres de ligação
Considera-se que se mais que a soma de e , é positivamente cooperativo. Se for menor, então é negativamente cooperativo. A química hospedeiro-hóspede não se limita às interações receptor-lingand. Também é demonstrado em sistemas de emparelhamento de íons. Nos últimos anos, essas interações foram estudadas em um meio aquoso utilizando hospedeiros organometálicos sintéticos e moléculas convidadas orgânicas. Por exemplo, um receptor policatiônico contendo cobre (o hospedeiro) é coordenado com moléculas como tetracarboxilatos, tricarbolato, aspartato e acetato (os convidados). Este estudo ilustra que a entropia, ao invés da entalpia, determina a energia de ligação do sistema levando à cooperatividade negativa. A grande mudança na entropia se origina do deslocamento das moléculas de solvente que cercam o ligante e o receptor. Quando vários acetatos se ligam ao receptor, ele libera mais moléculas de água para o ambiente do que um tetracarboxilato. Isso levou a uma diminuição da energia livre, o que implica que o sistema está cooperando negativamente. Em um estudo semelhante, utilizando guanidínio e Cu (II) e hóspedes de policarboxilato, é demonstrado que a cooperação positiva é amplamente determinada pela entalpia. Além dos estudos termodinâmicos, a química hospedeiro-hóspede também tem aplicações biológicas.
Supercondutividade
Em baixas temperaturas e altas pressões, descobriu-se que o bismuto exibe uma estrutura hospedeiro-hóspede. Isso surpreendentemente leva a uma forte supercondutividade de acoplamento.
Aplicação biológica
Os dendrímeros em sistemas de entrega de drogas são um exemplo de várias interações hospedeiro-hóspede. A interação entre o hospedeiro e o hóspede, o dendrímero e a droga, respectivamente, pode ser hidrofóbica ou covalente. A interação hidrofóbica entre o hospedeiro e o hóspede é considerada "encapsulada", enquanto as interações covalentes são consideradas conjugadas. O uso de dendrímeros na medicina demonstrou melhorar a distribuição do medicamento, aumentando a solubilidade e a biodisponibilidade do medicamento. Em conjunto, os dendrímeros podem aumentar a captação celular e a capacidade de direcionamento e diminuir a resistência aos medicamentos.
A solubilidade de vários antiinflamatórios não esteróides (AINE) aumenta quando eles são encapsulados em dendrímeros PAMAM. Este estudo mostra que o aumento da solubilidade de NSAID é devido às interações eletrostáticas entre os grupos amina de superfície em PAMAM e os grupos carboxila encontrados em NSAIDs. Contribuindo para o aumento da solubilidade estão as interações hidrofóbicas entre os grupos aromáticos nos fármacos e as cavidades internas do dendrímero. Quando uma droga é encapsulada dentro de um dendrímero, suas propriedades físicas e fisiológicas permanecem inalteradas, incluindo não especificidade e toxicidade. No entanto, quando o dendrímero e a droga estão covalentemente ligados entre si, ele pode ser usado para direcionamento de tecido específico e taxas de liberação controlada. A conjugação covalente de vários medicamentos em superfícies de dendrímero pode representar um problema de insolubilidade.
Este princípio também está sendo estudado para aplicação no tratamento do câncer. Vários grupos encapsularam medicamentos anticâncer, como: camptotecina , metotrexato e doxorrubicina . Os resultados dessas pesquisas mostraram que os dendrímeros aumentaram a solubilidade aquosa, diminuíram a taxa de liberação e, possivelmente, controlaram a citotoxicidade das drogas. A cisplatina foi conjugada a dendrímeros PAMAM que resultaram nos mesmos resultados farmacológicos listados acima, mas a conjugação também ajudou no acúmulo de cisplatina em tumores sólidos na administração intravenosa.
de detecção
Tradicionalmente, o sensoriamento químico tem sido abordado com um sistema que contém um indicador ligado covalentemente a um receptor através de um ligante. Assim que o analito se liga, o indicador muda de cor ou fica fluorescente. Essa técnica é chamada de abordagem indicador-espaçador-receptor (ISR). Em contraste com ISR, o ensaio de deslocamento de indicador (IDA) utiliza uma interação não covalente entre um receptor (o hospedeiro), indicador e um analito (o hóspede). Semelhante ao ISR, o IDA também utiliza indicadores colorimétricos (C-IDA) e de fluorescência (F-IDA). Em um ensaio IDA, um receptor é incubado com o indicador. Quando o analito é adicionado à mistura, o indicador é liberado para o meio ambiente. Assim que o indicador é liberado, ele muda de cor (C-IDA) ou fica fluorescente (F-IDA).
A IDA oferece várias vantagens em relação à abordagem tradicional de detecção química ISR. Primeiro, não requer que o indicador seja covalentemente ligado ao receptor. Em segundo lugar, uma vez que não há ligação covalente, vários indicadores podem ser usados com o mesmo receptor. Por último, os meios nos quais o ensaio pode ser usado são diversos.
As técnicas de detecção química, como C-IDA, têm implicações biológicas. Por exemplo, a protamina é um coagulante administrado rotineiramente após cirurgia cardiopulmonar que neutraliza a atividade anticoagulante da herapina. A fim de quantificar a protamina em amostras de plasma, um ensaio de deslocamento colorimétrico é usado. O corante Azure A é azul quando não ligado, mas quando está ligado ao herapin, mostra uma cor roxa. A ligação entre o Azure A e a heparina é fraca e reversível. Isso permite que a protamina desloque o Azure A. Uma vez que o corante é liberado, ele exibe uma cor roxa. O grau de deslocamento do corante é proporcional à quantidade de protamina no plasma.
O F-IDA foi usado por Kwalczykowski e colaboradores para monitorar as atividades da helicase em E. coli . Neste estudo, eles usaram laranja tiazol como indicador. A helicase desenrola o dsDNA para formar o ssDNA. A intensidade de fluorescência do tiazol laranja tem uma afinidade maior para o dsDNA do que para o ssDNA e sua intensidade de fluorescência aumenta quando está ligado ao dsDNA do que quando não está ligado.
Troca conformacional
Um sólido cristalino tem sido tradicionalmente visto como uma entidade estática onde os movimentos de seus componentes atômicos são limitados ao seu equilíbrio vibracional. Como pode ser visto pela transformação do grafite em diamante, a transformação de sólido em sólido pode ocorrer sob pressão física ou química. Recentemente, foi proposto que a transformação de um arranjo de cristal para outro ocorre de forma cooperativa. A maioria desses estudos tem se concentrado no estudo de uma estrutura orgânica ou metal-orgânica. Além dos estudos de transformação cristalina macromolecular, também existem estudos de moléculas monocristalinas que podem alterar sua conformação na presença de solventes orgânicos. Foi demonstrado que um complexo organometálico se transforma em várias orientações, dependendo se é exposto aos vapores do solvente ou não.
Aplicações ambientais
Sistemas hospedeiros convidados têm sido utilizados para remover materiais perigosos do meio ambiente. Eles podem ser feitos em tamanhos e formas diferentes para capturar uma variedade de convidados químicos. Uma aplicação é a capacidade do p-terc-butycalix [4] areno de capturar um íon de césio. O césio-137 é radioativo e é necessário removê-lo dos resíduos nucleares de maneira eficiente. A química hospedeiro-hóspede também tem sido usada para remover aminas aromáticas cancerígenas e seus derivados N-nitroso da água. Esses resíduos são usados em muitos processos industriais e encontrados em uma variedade de produtos, como: pesticidas, medicamentos e cosméticos.



![{\ displaystyle K_ {a} ^ {\ ominus} = {\ frac {\ {HG \}} {\ {H \} \ {G \}}} = {\ frac {[HG]} {[H] [ G]}} \ times \ Gamma}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\ displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{\ displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\ displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{\ displaystyle K_ {a} = {\ frac {[HG]} {[H] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\ displaystyle K = {\ frac {[HG]} {[H] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\ displaystyle T_ {H} = [H] + K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\ displaystyle T_ {G} = [G] + K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\ displaystyle [H] = T_ {H} -T_ {G} + [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\ displaystyle [HG] = K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)





















![{\ displaystyle \ beta _ {pq} = {\ frac {[H_ {p} G_ {q}]} {[H] ^ {p} [G] ^ {q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\ displaystyle T_ {H} = [H] + \ sum p \ beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\ displaystyle T_ {G} = [G] + \ sum q \ beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\ displaystyle [H_ {p} G_ {q}] = \ beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)














![{\ displaystyle Q = {V \ Delta H_ {0} [HG]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{\ displaystyle Q = {\ frac {V \ Delta H_ {0} K_ {a} [H_ {0}] [G]} {1 + K_ {a} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\ displaystyle [H_ {0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)













