Ácido iódico - Iodic acid
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
| Outros nomes
Ácido iódico (V)
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100.029.056 |
||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
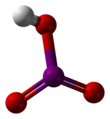
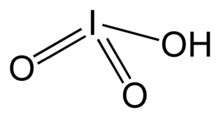
| HIO 3 | |||
| Massa molar | 175,91 g / mol | ||
| Aparência | Sólido branco | ||
| Densidade | 4,62 g / cm 3 , sólido | ||
| Ponto de fusão | 110 ° C (230 ° F; 383 K) | ||
| 269 g / 100 mL (20 ° C) | |||
| Acidez (p K a ) | 0,75 | ||
| Base conjugada | Iodado | ||
| −48,0 · 10 −6 cm 3 / mol | |||
| Perigos | |||
| Riscos principais | ácido, corrosivo, oxidante | ||
| NFPA 704 (diamante de fogo) | |||
| Ponto de inflamação | Não inflamável | ||
| Compostos relacionados | |||
|
Outros cátions
|
Iodato de lítio iodato de potássio |
||
|
Ácido clórico ácido brômico |
|||
|
Compostos relacionados
|
Ácido hidroiódico Pentóxido de iodo Ácido periódico |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O ácido iódico é um sólido branco solúvel em água com a fórmula química HIO 3 . Sua robustez contrasta com a instabilidade do ácido clórico e ácido brômico . O ácido iódico apresenta iodo no estado de oxidação +5 e é um dos oxo-ácidos mais estáveis dos halogênios. Quando aquecidas, as amostras desidratam para dar pentóxido de iodo . Em aquecimento posterior, o pentóxido de iodo se decompõe ainda mais, dando uma mistura de iodo, oxigênio e óxidos de iodo mais baixos.
Preparação
O ácido iódico pode ser produzido pela oxidação do iodo I 2 com oxidantes fortes, como o ácido nítrico HNO
3 , cloro Cl
2 , ácido clorídrico HClO
3 ou peróxido de hidrogênio H
2 O
2 , por exemplo:
Propriedades
O ácido iódico é um ácido relativamente forte com um p K a de 0,75. É fortemente oxidante em solução ácida, menos em solução básica. Quando o ácido iódico atua como oxidante, o produto da reação é o iodo ou o íon iodeto. Sob algumas condições especiais (pH muito baixo e alta concentração de íons cloreto, como no ácido clorídrico concentrado), o ácido iódico é reduzido a tricloreto de iodo , um composto amarelo dourado em solução e nenhuma redução adicional ocorre. Na ausência de íons cloreto, quando há uma quantidade excessiva de redutor, todo o iodato é convertido em íon iodeto. Quando há uma quantidade excessiva de iodato, parte do iodato é convertida em iodo. Pode ser usado na preparação de ionização para formar halogenetos de alquila.
Usos
O ácido iódico é usado como um ácido forte em química analítica . Pode ser usado para padronizar soluções de bases fortes e fracas , usando vermelho de metila ou laranja de metila como indicador .
Uso na indústria de sal
O ácido iódico pode ser usado para sintetizar iodato de sódio ou potássio para aumentar o teor de iodo do sal.
Outros oxiácidos
O iodato é parte de uma série de oxiácidos nos quais o iodo pode assumir estados de oxidação de -1, +1, +3, +5 ou +7. Vários óxidos de iodo neutros também são conhecidos.
| Estado de oxidação de iodo | -1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Nome | Iodeto de hidrogênio | Ácido hipoiodoso | Ácido iodoso | Ácido iódico | Ácido periódico |
| Fórmula | OI | HIO | HIO 2 | HIO 3 | HIO 4 ou H 5 IO 6 |
Referências
- ^ Holleman, Arnold F .; Wiberg, Nils (2007). Lehrbuch der Anorganischen Chemie (em alemão) (102ª ed.). Berlim. ISBN 978-3-11-017770-1 .