Ataluren - Ataluren
 | |
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Translarna |
| Outros nomes | PTC124 |
| AHFS / Drugs.com | Nomes de medicamentos internacionais |
| Dados de licença | |
| Vias de administração |
Pela boca |
| Código ATC | |
| Status legal | |
| Status legal | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.132.097 |
| Dados químicos e físicos | |
| Fórmula | C 15 H 9 F N 2 O 3 |
| Massa molar | 284,246 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
|
| |
Ataluren , vendido sob a marca Translarna , é um medicamento para o tratamento da distrofia muscular de Duchenne . Ele foi projetado pela PTC Therapeutics .
Uso médico
O atalureno é usado na União Europeia para tratar pessoas com distrofia muscular de Duchenne que apresentam uma mutação absurda no gene da distrofina , podem andar e têm mais de cinco anos de idade.
Contra-indicações
Pessoas que estão grávidas ou amamentando não devem tomar atalureno.
Efeitos adversos
Mais de 10% das pessoas que tomaram atalureno em estudos clínicos experimentaram vômitos; mais de 5% tiveram diarreia, náusea, dor de cabeça, dor abdominal superior e flatulência; entre 1% e 5% das pessoas experimentaram diminuição do apetite e perda de peso, níveis elevados de triglicerídeos , pressão alta, tosse, sangramento nasal, desconforto abdominal, constipação, erupções cutâneas, dor nos braços, pernas e músculos do peito, sangue na urina , incontinência urinária e febre.
Interações
Os aminoglicosídeos não devem ser administrados a pessoas que estejam tomando atalureno, pois interferem no seu mecanismo de ação. Deve-se ter cuidado com medicamentos que induzem UGT1A9 ou que são substratos de OAT1 , OAT3 ou OATP1B3 .
Farmacologia
Embora um grande número de estudos não tenha conseguido identificar o alvo biológico do atalureno, descobriu-se que ele se ligava e estabilizava a luciferase do pirilampo, explicando assim o mecanismo pelo qual criava um efeito falso positivo no ensaio de leitura.
Acredita-se que o atalureno torne os ribossomos menos sensíveis aos códons de parada prematura (um efeito referido como "leitura"), promovendo a inserção de certo tRNA quase cognato no local de códons sem sentido sem efeitos aparentes na transcrição downstream , processamento de mRNA , estabilidade do mRNA ou da proteína resultante, tornando assim uma proteína funcional semelhante ao produto endógeno não mutado. Parece funcionar particularmente bem para o códon de parada 'UGA'.
Estudos demonstraram que o tratamento com atalureno aumenta a expressão da proteína distrofina de comprimento total em células musculares primárias humanas e de camundongo contendo a mutação do códon de parada prematura para distrofia muscular de Duchenne e resgata a função do músculo estriado. Estudos em camundongos com mutação prematura no códon de parada para fibrose cística demonstraram aumento na produção e função da proteína CFTR. Estendendo este trabalho, um estudo mecanístico com leveduras e células humanas elucidou os detalhes dos pares de bases de códon-anticódon não padronizados mediados por atalureno que resultam em substituições de aminoácidos específicos em posições de códon específicas na proteína CFTR.
A revisão da Agência Europeia de Medicamentos sobre a aprovação do atalureno concluiu que “os dados não clínicos disponíveis foram considerados suficientes para apoiar o mecanismo de ação proposto e para aliviar as preocupações anteriores sobre a seletividade do atalureno para códons de parada prematuros”.
Química
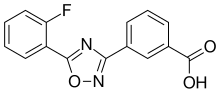
Ataluren é um oxadiazol ; seu nome químico é ácido 3- [5- (2-fluorofenil) -1,2,4-oxadiazol-3-il] benzóico.
História
Ataluren foi descoberto por cientistas da PTC Therapeutics em uma colaboração com o laboratório de Lee Sweeney na Universidade da Pensilvânia, que foi inicialmente financiado em parte pelo Parent Project Muscular Dystrophy. A equipe usou a triagem fenotípica de uma biblioteca química para identificar compostos que aumentaram a quantidade de proteína expressa por genes mutantes e, em seguida, otimizou um dos acertos na tela para criar essa droga. Tal como acontece com os resultados de muitos rastreios baseados em células, o alvo biológico do atalureno não é conhecido.
Os ensaios clínicos de Fase I começaram em 2004.
Em 2010, a PTC Therapeutics divulgou os resultados preliminares de seu ensaio clínico de fase 2b para distrofia muscular de Duchenne, com os participantes não apresentando uma melhora significativa na distância percorrida em seis minutos após 48 semanas do ensaio. Esse fracasso resultou na rescisão de um contrato de US $ 100 milhões com a Genzyme para buscar o medicamento.
Em maio de 2014, o atalureno recebeu um parecer positivo do Comitê de Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos (EMA) e recebeu autorização de comercialização da Comissão Europeia para tratar pessoas com distrofia muscular de Duchenne mutação nonsense em agosto de 2014; foi necessário um ensaio clínico confirmatório de fase III. Em dezembro, estava no mercado na Alemanha, França, Itália, Dinamarca, Espanha e em vários outros países da União Europeia.
Em fevereiro de 2016, o FDA recusou-se a aceitar o novo pedido de medicamento da PTC Therapeutics para o atalureno, que foi baseado em um ensaio clínico no qual o atalureno perdeu seu desfecho primário; A PTC recorreu e o FDA recusou novamente em outubro de 2016.
Em julho de 2016, o NHS England concordou com um Acordo de Acesso Gerenciado (MAA) para o Translarna, fornecendo acesso reembolsado ao paciente para o Translarna na Inglaterra por meio de um MAA de cinco anos. Isto seguiu uma recomendação positiva do Instituto Nacional de Excelência em Saúde e Cuidados (NICE) em abril de 2016, sujeito a PTC e NHS England finalizar os termos do MAA. O NICE emitiu sua orientação final no final de julho, com a implementação do MAA para pacientes que o seguiram dentro de dois meses.
Em março de 2017, o PTC encerrou o desenvolvimento de atalureno para fibrose cística devido à falta de eficácia nos estudos de Fase III.
Veja também
- Biostrofina , rimeporida e eteplirsen , outras drogas contra a distrofia muscular de Duchenne
- Ivacaftor e lumacaftor , outros medicamentos contra a fibrose cística em desenvolvimento pela Vertex Pharmaceuticals
Referências
links externos
- "Ataluren" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
