Doença de Sandhoff - Sandhoff disease
| Doença de Sandhoff | |
|---|---|
| Outros nomes | Doença de Sandhoff-Jatzkewitz , variante 0 da GM2-gangliosidose ou deficiência de hexosaminidase A e B |
 | |
| A doença de Sandhoff é herdada de forma autossômica recessiva. | |
| Especialidade |
Endocrinologia |
A doença de Sandhoff é um distúrbio genético lisossomal de armazenamento de lipídios causado pela deficiência hereditária para criar beta-hexosaminidases A e B. Essas enzimas catabólicas são necessárias para degradar os componentes da membrana neuronal, gangliósido GM2, seu derivado GA2, o glicolipídeo globosídeo em tecidos viscerais e alguns oligossacarídeos. O acúmulo desses metabólitos leva a uma destruição progressiva do sistema nervoso central e, eventualmente, à morte. O raro distúrbio neurodegenerativo autossômico recessivo é clinicamente quase indistinguível da doença de Tay-Sachs , outro distúrbio genético que interrompe as beta-hexosaminidases A e S. Existem três subconjuntos da doença de Sandhoff com base em quando os primeiros sintomas aparecem: clássico infantil, juvenil e adulto de início tardio .
Sintomas e sinais
Os sintomas da doença de Sandhoff são clinicamente indeterminados pela doença de Tay-Sachs . A forma infantil clássica da doença apresenta os sintomas mais graves e é incrivelmente difícil de diagnosticar nesta idade. Os primeiros sinais de sintomas começam antes dos 6 meses de idade e os pais percebem quando a criança começa a regredir em seu desenvolvimento. Se as crianças conseguissem sentar-se sozinhas ou engatinhar, perderiam essa capacidade. Isso é causado por uma lenta deterioração dos músculos do corpo da criança devido ao acúmulo de gangliosídeos GM2 . Como o corpo é incapaz de criar as enzimas de que necessita no sistema nervoso central , ele é incapaz de se ligar a esses gangliosídeos para separá-los e torná-los atóxicos. Com esse acúmulo, vários sintomas começam a aparecer, como fraqueza muscular / motora, reação aguda a ruídos altos, cegueira, surdez, incapacidade de reagir a estimulantes, problemas respiratórios e infecções, retardo mental, convulsões, manchas vermelhas na retina , fígado e baço aumentados ( hepatoesplenomegalia ), pneumonia ou broncopneumonia .
As outras duas formas da doença de Sandhoff apresentam sintomas semelhantes, mas em menor grau. As formas adultas e juvenis da doença de Sandhoff são mais raras do que a infantil. Nesses casos, as vítimas sofrem comprometimento cognitivo (retardo) e uma perda de coordenação muscular que prejudica e eventualmente destrói sua capacidade de andar; as manchas vermelhas características na retina também se desenvolvem. A forma adulta da doença, no entanto, às vezes é mais branda e pode levar apenas à fraqueza muscular que prejudica a marcha ou a capacidade de se levantar da cama.
Causas
Dois pais que carregam um gene mutado e o transmitem aos filhos causam a doença. Mesmo com ambos os pais portadores da doença em seu genoma , há apenas 25% de chance de que eles tenham um filho contendo o código genético da doença (veja a figura à direita).
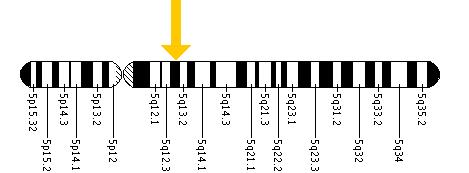
Cada forma da doença é causada pelas diferenças nas várias mutações do genoma, em particular os códons nos 14 exons no gene HEX B localizados dentro do cromossomo 5 (ver figura abaixo), levando às diferenças na gravidade dos sintomas . A diferença nos códons tem como consequência a inibição de duas enzimas localizadas nos lisossomas dos neurônios do sistema nervoso central. Os lisossomos contêm várias enzimas para quebrar subprodutos e toxinas para garantir que não se acumulem o suficiente para interferir com o funcionamento do sistema nervoso central.
Usando enzimas de restrição, foi descoberto que uma mutação no cromossomo 5, particularmente dentro do alelo C1214T, causou a forma adulta de início da doença de Sandhoff. Para o paciente que apresenta sintomas da forma infantil ou juvenil, eles têm uma mutação no exon I207V de seu pai e uma deleção de 16 pares de bases de sua mãe, que pode estar localizada em até cinco exons, exons 1-5.
Mutações e polimorfismo
Os artigos relativos às frequências da doença de Sandhoff entre grupos distintos de pessoas contêm discrepâncias entre si. Mais de 25 mutações foram relatadas além de novas mutações.
Um artigo diz que a doença de Sandhoff é comumente encontrada em indivíduos de ascendência não judia.
Outros dizem que é mais comum em:
- a população crioula do norte da Argentina
- os indígenas Métis em Saskatchewan
- Comunidades cristãs maronitas de Chipre
A descoberta de várias mutações em judeus Ashkenazi pode refletir um viés de apuração, em vez de uma alta frequência populacional, porque os judeus Ashkenazi eram a população-alvo em um programa de triagem em massa para a doença de Tay-Sachs. Várias mutações SD raras foram descobertas enquanto os pesquisadores resolviam casos de deficiência enzimática entre os portadores suspeitos de TSD, mas nenhum caso da doença em si foi relatado.
No entanto, por ser uma doença autossômica recessiva, é provável que seja encontrada em qualquer grupo étnico, passando de geração em geração por meio de portadores, sem se manifestar em seus descendentes. Mesmo que a família não tenha histórico da doença de Sandhoff, é possível que duas pessoas tenham um filho com a doença. Como a doença de Sandhoff só foi descoberta em 1968, há anos ela não era detectada por causa de diagnósticos errados.
Fisiopatologia
Variantes patogênicas bialélicas no gene HEXB causam a doença de Sandhoff. O gene fornece instruções para fazer uma proteína crucial para as enzimas beta-hexosaminidase A e beta-hexosaminidase B , que funcionam nas células nervosas para quebrar substâncias gordurosas, açúcares complexos e moléculas ligadas aos açúcares. Em particular, a beta-hexosaminidase A decompõe um composto graxo chamado gangliósido GM2. Mutações no gene HEXB interrompem a atividade dessas enzimas, evitando a quebra do gangliosídeo GM2 e de outras moléculas.
Como resultado, o dano progressivo causado pelo acúmulo resultante de gangliosídeo GM2 leva à destruição das células nervosas, causando os sinais e sintomas associados à doença de Sandhoff.
Diagnóstico
A doença de Sandhoff pode ser detectada por meio dos seguintes procedimentos (antes que seja aparente por meio de exame físico): uma biópsia removendo uma amostra de tecido do fígado , teste genético , análise molecular de células e tecidos (para determinar a presença de um distúrbio metabólico genético ) , ensaio enzimático e, ocasionalmente, urinálise para determinar se os compostos mencionados acima estão anormalmente armazenados no corpo. Para que uma criança sofra desta doença, ambos os pais devem ser portadores e ambos devem transmitir a mutação para a criança. Portanto, mesmo no caso em que ambos os pais têm a mutação, há apenas 25% de chance de seu filho herdar a doença. Freqüentemente, os pais têm a oportunidade de fazer um teste de DNA , se estiverem sob alto risco, para determinar sua condição de portador antes de terem filhos. No entanto, também é altamente recomendável fazer o teste, mesmo para os pais que não têm história familiar de doença de Sandhoff. Mais de 95% das famílias que têm filhos com a doença de Sandhoff não tinham história familiar anterior da doença, pois a mutação no gene HEXB não causa sintomas clínicos quando apenas uma cópia está presente, e muitas vezes passou despercebida de uma geração para a próximo Naturalmente, se um indivíduo for portador da mutação, ele ou ela corre o risco de transmiti-la ao feto. O aconselhamento genético é recomendado para aqueles que têm a mutação.
É possível que os pais que estão prestes a ter um filho ou tiveram um filho com a doença de Sandhoff possam ter um PGD ou PEGD. PEGD é o diagnóstico genético pré-embrionário para os pais que não se beneficiariam de um diagnóstico genético pré-implantação por causa de sua religião ou atitude negativa para o descarte de embriões. O PEGD sequencia o genoma do embrião para ser produzido por dois pais se eles concebessem um filho. Se a família tiver um histórico de doença de Sandhoff, é recomendável sequenciar o genoma para garantir que não sejam portadores ou para sequenciar o genoma de seu filho.
Tipos
Existem três tipos de doença de Sandhoff: início tardio infantil, juvenil e adulto clássico. Cada forma é classificada pela gravidade dos sintomas, bem como pela idade em que o paciente apresenta esses sintomas.
- A forma infantil clássica da doença é classificada pelo desenvolvimento de sintomas entre os 2 meses e os 9 meses de idade. É a mais comum e a mais grave de todas as formas e levará à morte antes de o paciente atingir a idade de três anos. Bebês com esse transtorno geralmente parecem normais até a idade de 3 a 6 meses, quando o desenvolvimento fica mais lento e os músculos usados para movimentos enfraquecem. Bebês afetados perdem habilidades motoras , como virar, sentar e engatinhar. À medida que a doença progride, os bebês desenvolvem convulsões, perda de visão e audição, demência e paralisia . Uma anormalidade ocular denominada mancha vermelho-cereja , que pode ser identificada com um exame oftalmológico, é característica desse distúrbio. Alguns bebês com a doença de Sandhoff podem ter órgãos aumentados ( organomegalia ) ou anormalidades ósseas. As crianças com a forma grave desse transtorno geralmente vivem apenas na primeira infância.
- A forma juvenil da doença apresenta sintomas a partir dos 3 anos de idade até os 10 anos e, embora a criança geralmente morra por volta dos 15 anos, é possível que vivam mais se estiverem sob cuidados constantes. Os sintomas incluem autismo , ataxia, regressão das habilidades motoras, espacialidade e distúrbios de aprendizagem.
- A forma de aparecimento da doença no adulto é classificada pela sua ocorrência em indivíduos mais velhos e tem efeito sobre a função motora desses indivíduos. Ainda não se sabe se a doença de Sandhoff fará com que esses indivíduos tenham uma redução no tempo de vida.
As formas juvenis e adultas da doença de Sandhoff são muito raras. Os sinais e sintomas podem começar na infância, adolescência ou idade adulta e geralmente são mais leves do que aqueles observados na forma infantil da doença de Sandhoff. Como na forma infantil, as habilidades mentais e a coordenação são afetadas. As características características incluem fraqueza muscular, perda de coordenação muscular ( ataxia ) e outros problemas de movimento, fala e doença mental. Esses sinais e sintomas variam amplamente entre as pessoas com formas de início tardio da doença de Sandhoff.
Tratamento
Atualmente a doença de Sandhoff não tem nenhum tratamento padrão e não tem cura. No entanto, uma pessoa que sofre da doença precisa de nutrição adequada, hidratação e manutenção das vias aéreas desobstruídas. Para reduzir alguns sintomas que podem ocorrer com a doença de Sandhoff, o paciente pode tomar anticonvulsivantes para controlar convulsões ou medicamentos para tratar infecções respiratórias e consumir uma dieta precisa composta de alimentos purê devido à dificuldade de engolir. Bebês com a doença geralmente morrem aos 3 anos de idade devido a infecções respiratórias. O paciente deve estar sob vigilância constante porque pode sofrer de aspiração ou não ter a capacidade de mudar da passagem para os pulmões em relação ao estômago e sua saliva viaja para os pulmões causando broncopneumonia. O paciente também não tem a capacidade de tossir e, portanto, deve passar por um tratamento para sacudir o corpo e remover o muco do revestimento dos pulmões. A medicação também é dada aos pacientes para diminuir seus sintomas, incluindo convulsões.
Atualmente, o governo está testando vários tratamentos, incluindo N-butil-desoxinojirimicina em camundongos, bem como tratamento com células-tronco em humanos e outros tratamentos médicos que recrutam pacientes para teste. Um estudo da doença de Sandhoff que mostra a prova do princípio da terapia gênica em um sistema de modelo humano usando CRISPR e correção do gene do vírus dá a chance de ensaios clínicos para curar a doença. A ocorrência ultra-rara é o principal obstáculo a ser superado para os ensaios clínicos.
História
A doença de Sandhoff é uma das várias formas do que antes era conhecido como idiotice amaurótica. Esta doença hereditária é caracterizada pelo acúmulo de células contendo lipídios nas vísceras e no sistema nervoso, retardo mental e deficiência visual ou cegueira. A análise química e enzimática de vários pacientes com idiotice amaurótica por Konrad Sandhoff (1939-), um bioquímico alemão, levou à identificação de várias doenças bioquimicamente distintas: A primeira descrição bioquímica de GM1-gangliosidose em 1963, doença de Sandhoff em 1968, Tay -Sachs-Disease, a variante AB de GM2-Gangliosidose e a variante B1 de GM2-gangliosidose.
O defeito molecular na doença de Sandhoff foi descoberto quando Konrad Sandhoff estudou a bioquímica de esfingolipídeos e gangliosídeos no laboratório do Prof. Horst Jatzkewitz (1912–2002), um bioquímico alemão (Max-Planck-Institute for Psychiatry, Munich). Em outubro de 1966, ele obteve material de autópsia ultracongelado de um caso infantil com idiotice amaurótica. A análise do glicolipídeo logo demonstrou diferenças em relação a todos os casos estudados antes. Além do armazenamento neuronal de GM2, o armazenamento de GA2 foi muito mais pronunciado e, diferente de todos os casos de doença de Tay-Sachs estudados até agora, o globosídeo se acumulou nos órgãos viscerais e, o mais importante, a atividade da hexosaminidase estava quase totalmente ausente. A doença que causa deficiência de enzima catabólica de hexosaminidases foi demonstrada com quatro substratos diferentes (p-nitrofenil-β-DN-acetilglucosaminida, p-nitrofenil-β-DN-acetilgalactosaminida, glicolipídeo [3H] GA2 e [3H] globosídeo) em quatro órgãos diferentes e publicado em 1968.
Veja também
Referências
Este artigo incorpora algum texto de domínio público da Biblioteca Nacional de Medicina dos EUA
links externos
| Classificação | |
|---|---|
| Fontes externas |

