Siderocalina - Siderocalin
| Lipocalina associada à gelatinase de neutrófilos / lipocalina-12 específica do epidídimo | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Apelido | LCN2 / LCN12IPR003087Siderocalina | ||||||
| IDs externos | GeneCards : [1] | ||||||
| Ortólogos | |||||||
| Espécies | Humano | Mouse | |||||
| Entrez |
|
|
|||||
| Conjunto |
|
|
|||||
| UniProt |
|
||||||
| RefSeq (mRNA) |
|
|
|||||
| RefSeq (proteína) |
|
|
|||||
| Localização (UCSC) | n / D | n / D | |||||
| Pesquisa PubMed | n / D | n / D | |||||
| Wikidata | |||||||
| |||||||
A siderocalina (Scn) , lipocalina-2 , NGAL , 24p3 é uma proteína do tipo lipocalina de mamíferos que pode prevenir a aquisição de ferro por bactérias patogênicas ligando-se a sideróforos , que são quelantes de ligação de ferro produzidos por microrganismos. Ferro serve como um nutriente chave nos hospedeiro - patógeno interacções, e agentes patogénicos podem adquirir ferro a partir do organismo hospedeiro através de síntese e libertação sideróforos como enterobactina . A siderocalina faz parte do mecanismo de defesa dos mamíferos e atua como um agente antibacteriano . Cristalográficas estudos de Scn demonstrou que inclui um cálice , um ligando - domínio de ligação que está alinhada com polares catiónicos grupos. No centro do mecanismo de reconhecimento sideróforo / siderocalina estão as interações híbridas eletrostática / cátion - pi . Para escapar das defesas do hospedeiro, os patógenos evoluíram para produzir sideróforos estruturalmente variados que não seriam reconhecidos pela siderocalina, permitindo que as bactérias adquirissem ferro.
Requisitos de ferro dos organismos hospedeiros
Os organismos requerem ferro para uma variedade de reações químicas . Embora o ferro possa ser encontrado em toda a biosfera , o ferro férrico livre forma hidróxidos insolúveis em pH fisiológico , limitando sua acessibilidade em condições aeróbias aos organismos vivos. Para preservar a homeostase , os organismos desenvolveram redes de proteínas específicas, com proteínas e receptores traduzidos de acordo com os níveis de ferro intracelular . A exportação e a importação são complementadas por um processo de ciclagem entre o Fe ferroso (II) disponível no ambiente redutor da célula e o Fe férrico (III) encontrado principalmente em condições aeróbias. Os mecanismos de aquisição de ferro por bactérias patogênicas demonstram o papel do ferro como um componente chave na interface entre patógenos e hospedeiros.
Família da lipocalina de proteínas de ligação ao ferro
A família das lipocalinas de proteínas de ligação são produzidas pelo sistema imunológico e sequestram os complexos sideróforos férricos dos receptores sideróforos das bactérias. A família de lipocalinas de proteínas de ligação tipicamente tem uma prega de barril β de oito fitas conservada com um sítio de ligação de cálice , que são revestidos com resíduos de aminoácidos carregados positivamente , permitindo interações de ligação com sideróforos.
Significado clínico
Infecções micobacterianas
A lipocalina siderocalina é encontrada nos grânulos de neutrófilos , nas secreções uterinas e em níveis particularmente elevados no soro durante a infecção bacteriana . Após a infecção, os patógenos usam sideróforos para capturar o ferro do organismo hospedeiro. Esta estratégia é, no entanto, complicada pela proteína humana siderocalina, que pode sequestrar sideróforos e prevenir seu uso por bactérias patogênicas como agentes de entrega de ferro. Esse efeito foi demonstrado por estudos com camundongos knock-out para siderocalina , que são mais sensíveis a infecções em condições de limitação de ferro.
Virulência micobacteriana
Os sideróforos são quelantes de ferro, permitindo que organismos adquiram ferro de seu ambiente. No caso de patógenos, o ferro pode ser adquirido do organismo hospedeiro. Sideróforos e ferro férrico podem se associar para formar complexos estáveis. Os sideróforos ligam o ferro usando uma variedade de ligantes , mais comumente como α-hidroxicarboxilatos (por exemplo, citrato), catecolatos e hidroxamatos . Como mecanismo de defesa, a siderocalina pode substituir os complexos de bis-catecol férrico (formados em condições fisiológicas) por um terceiro catecol, a fim de obter um complexo férrico hexacoordenado , resultando em uma ligação de maior afinidade.
Como mediador do transporte de ferro em mamíferos
Sideróforos de mamíferos, especificamente catecóis , podem ser encontrados no intestino humano e em sideróforos, como a enterobactina , e servem como porções de ligação ao ferro . As moléculas semelhantes a catecol podem atuar como ligantes de ferro na célula e na circulação sistemática , permitindo que a siderocalina se ligue ao complexo ferro-catecol. Os catecóis podem ser ligados pela siderocalina, na forma de ligantes livres ou no complexo de ferro. 24p3 é um receptor de lipocalina-2 de vertebrado que permite a importação do complexo sideróforo férrico para células de mamíferos. Durante a embriogênese renal , ocorre o transporte de ferro mediado pela siderocalina, pois a concentração de ferro deve ser altamente controlada para restringir a inflamação . Após a secreção pelos neutrófilos, a siderocalina pode se ligar a sideróforos patogênicos, como a bacilibactina , e prevenir o tráfico de sideróforos. A siderocalina tem sido associada a vários processos celulares além do transporte de ferro, incluindo apoptose , diferenciação celular , tumorigênese e metástase .
Estrutura
Os ortólogos aviários de siderocalina (Q83 e Ex-FABP) e NGAL ( lipocalina-2 associada a neutrófilos gelatinase ) contêm cálices com cadeias laterais de lisina e arginina carregadas positivamente . Essas cadeias laterais interagem por meio de interações catiônicas pi e coulômbicas com os sideróforos carregados negativamente que contêm grupos catecolatos aromáticos . Estudos cristalográficos de siderocalina mostraram que o domínio de ligação ao ligante de Scn, conhecido como cálice, é raso e largo, e está alinhado com grupos catiônicos polares dos três resíduos carregados positivamente de Arg81, Lys125 e Lys134. Scn também pode ligar complexos não-férricos e foi identificado como um transportador potencial para íons actinídeos pesados. Estruturas de cristal de Scn contendo metais pesados (tório, plutônio, amerício, cúrio e califórnio) foram obtidas. Scn foi encontrado como um monómero , homo- dímero ou trímero em plasma humano. A prega siderocalina é excepcionalmente estável. O cálice é estruturalmente estável e rígido, e a mudança conformacional não ocorre tipicamente após uma mudança no pH , força iônica ou ligação do ligante.
Bolso de encadernação
A estabilidade estrutural do cálice foi atribuída aos três bolsos de ligação dentro do cálice que limitam estericamente quais ligantes são compatíveis com a siderocalina. O cálice Scn pode acomodar três anéis aromáticos das porções catecolato, nos três bolsos de ligação disponíveis. Os resultados estruturais de solução e de estado sólido demonstraram que a enterobactina derivada de bactérias está ligada à bolsa de ligação de Scn, permitindo que Scn esteja envolvido na resposta imune aguda à infecção bacteriana. Um método pelo qual os patógenos podem contornar os mecanismos de imunidade é pela modificação da estrutura química do sideróforo para evitar a interação com o Scn. Um exemplo é a adição de moléculas de glicose à estrutura de enterobactina da salmocelina ( enterobactina C- glicosilada ) para aumentar a hidrofilicidade e o volume de um sideróforo e inibir a ligação a Scn.
Interações de ligação
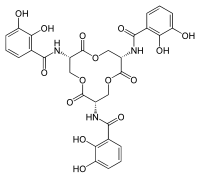
Os sideróforos são tipicamente ligados à siderocalina com afinidades sub nanomolares e interagem especificamente com a siderocalina. O valor Kd da interação siderocalina / sideróforo, medido por extinção de fluorescência (Kd = 0,4 nM), indica que a siderocalina pode capturar sideróforos com alta afinidade. Este valor Kd é semelhante ao do receptor bacteriano FepA (Kd = 0,3 nM). A ligação sideróforo / siderocalina é dirigida por interações eletrostáticas. Especificamente, o mecanismo envolve interações eletrostáticas híbridas e cátions-pi no cálice de proteína carregada positivamente. O sideróforo está posicionado no centro do cálice da siderocalina e está associado a múltiplas interações polares diretas. A análise estrutural da interação siderocalina / sideróforo mostrou que o sideróforo é acompanhado por uma qualidade pobre e difusa de densidade de elétrons , com a maioria do ligante exposta ao solvente quando o sideróforo está encaixado no cálice. A siderocalina normalmente não se liga a sideróforos à base de hidroxamato porque esses substratos não têm a estrutura eletrônica aromática necessária para as interações cátion-pi. Para adquirir ferro na presença de siderocalina, as bactérias patogênicas utilizam vários sideróforos que não se ligam à siderocalina, ou modificam estruturalmente os sideróforos para inibir a ligação da siderocalina. A siderocalina pode ligar-se a sideróforos solúveis de micobactérias , incluindo carboximicobactinas. Estudos in vivo demonstraram que as interações de ligação entre a carboximicobactina e a siderocalina servem para proteger o organismo hospedeiro de infecções por micobactérias, com a siderocalina inibindo a aquisição de ferro por micobactérias. A siderocalina pode sequestrar carboximicobactinas férricas , empregando um mecanismo de reconhecimento poliespecífico. O mecanismo de reconhecimento sideróforo / siderocalina envolve principalmente interações híbridas eletrostáticas / cátions-pi. As caudas de ácido graxo da carboximicobactina residem em uma conformação 'cauda para dentro' ou 'cauda para fora' dentro da cavidade 2. A conformação 'cauda para dentro' dos comprimentos da cadeia de ácido graxo introduz uma interação significativa entre o cálice e o ligante, aumentando a afinidade do cálice da siderocalina e da carboximicobactina. As caudas de ácido graxo de comprimento curto têm uma ligação correspondentemente menos favorável à siderocalina e não podem manter a interação necessária com a bolsa de ligação. Uma vez que a lipocalina-2 não pode se ligar às carboximicobactinas de cadeia de ácido graxo longa de micobactérias, é evidente que vários patógenos evoluíram para evitar a atividade da lipocalina-2.
Mecanismo de reconhecimento
A interação eletrostática desempenha um papel fundamental no mecanismo de reconhecimento dos sideróforos pela siderocalina. A ligação do sideróforo e da bolsa de ligação da siderocalina é dirigida principalmente por interações cátion-pi, com a bolsa de ligação carregada positivamente da siderocalina atraindo o complexo carregado negativamente. Um fator estrutural envolvido no mecanismo de reconhecimento mediado pela siderocalina de sideróforos do tipo fenolato / catecolato inclui um ligante de estrutura que permite que a siderocalina interaja com diferentes sideróforos fenolato / catecolato. Embora o reconhecimento da siderocalina seja minimamente afetado pela substituição de diferentes metais, a metilação dos três anéis catecolatos da enterobactina pode impedir o reconhecimento da siderocalina. Uma estratégia usada por patógenos para superar a resposta imune é a produção de sideróforos que não serão reconhecidos pela siderocalina. Por exemplo, a siderocalina não consegue reconhecer os sideróforos do análogo C-glucosilado da enterobactina, pois os grupos doadores são glicosilados , introduzindo interações estéricas na posição 5 carbonos dos grupos catecol.
História
A necessidade de ferro por humanos e patógenos é conhecida há muitos anos. A ligação entre o ferro e as micobactinas, fatores de crescimento quelantes do ferro das micobactérias , foi feita pela primeira vez na década de 1960. Na época, crescia o interesse em resolver uma aplicação de micobactinas como moléculas-alvo para um agente anti- tuberculose racional . Experimentos nas décadas de 1960 e 1970 demonstraram que a deficiência de ferro nas micobactérias era a causa das células " anêmicas " . A maioria dos genes e sistemas necessários para a aquisição de ferro de alta afinidade foram identificados em micobactérias patogênicas e saprofíticas . Esses genes codificam proteínas para armazenamento de ferro, absorção de sideróforos férricos e heme . Os humanos desenvolveram uma defesa para a aquisição de ferro mediada por sideróforos através do desenvolvimento da siderocalina. Para combater isso, vários patógenos desenvolveram sideróforos que podem escapar do reconhecimento da siderocalina. Foi demonstrado que a siderocalina se liga aos sideróforos e inibe a aquisição de ferro e previne o crescimento de Mycobacterium tuberculosis em culturas extracelulares ; entretanto, o efeito da siderocalina neste patógeno dentro dos macrófagos permanece obscuro.