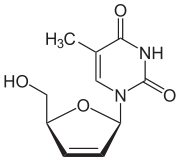
Estavudina - Stavudine
 | |
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Zerit |
| Outros nomes | 2 ′, 3′-didesidro-2 ′, 3′-didesoxitimidina |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a694033 |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Pela boca |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Biodisponibilidade | > 80% |
| Ligação proteica | Insignificante |
| Metabolismo | Eliminação de rim (~ 40%) |
| Meia-vida de eliminação | 0,8-1,5 horas (em adultos) |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| NIAID ChemDB | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.169.180 |
| Dados químicos e físicos | |
| Fórmula | C 10 H 12 N 2 O 4 |
| Massa molar | 224,216 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| (verificar) | |
A estavudina ( d4T ), vendida sob a marca Zerit, entre outros, é um medicamento anti - retroviral usado para prevenir e tratar o HIV / AIDS . Geralmente é recomendado para uso com outros anti-retrovirais. Pode ser usado para prevenção após ferimento por agulha ou outra exposição potencial. No entanto, não é um tratamento de primeira linha. É administrado por via oral.
Os efeitos colaterais comuns incluem dor de cabeça , diarreia, vômitos, erupção na pele e problemas nos nervos periféricos . Os efeitos colaterais graves incluem lactato sanguíneo alto , pancreatite e fígado aumentado . Geralmente não é recomendado durante a gravidez . A estavudina está na classe de medicamentos inibidores da transcriptase reversa análogos de nucleosídeos (NRTI).
A estavudina foi descrita pela primeira vez em 1966 e aprovada para uso nos Estados Unidos em 1994. Está disponível como medicamento genérico.
Usos médicos
A estavudina é usada no tratamento da infecção pelo HIV-1 , mas não é uma cura. Normalmente não é recomendado como tratamento inicial. A estavudina também pode reduzir o risco de desenvolver infecção pelo HIV-1 após entrar em contato com o vírus no trabalho (por exemplo, picada de agulha) ou por meio da exposição a sangue infectado ou outros fluidos corporais. É sempre usado em combinação com outros medicamentos anti-HIV para um melhor controle da infecção e redução das complicações do HIV.
A Organização Mundial da Saúde (OMS) recomenda que a estavudina seja descontinuada devido aos seus altos níveis de toxicidade. Caso seja necessário o uso do medicamento, recomenda-se o uso de doses baixas para diminuir a ocorrência de efeitos colaterais; no entanto, uma revisão da Cochrane de 2015 não encontrou nenhuma vantagem clara entre os regimes de dosagem alta e baixa.
Gravidez e amamentação
A estavudina demonstrou afetar o feto em estudos em animais, mas não existem dados disponíveis de estudos em humanos. Portanto, as mulheres grávidas devem receber estavudina apenas se os benefícios potenciais superarem os danos potenciais ao feto. Além disso, houve relatos de casos de acidose láctica fatal em mulheres grávidas recebendo terapia combinada de estavudina e didanosina com outros agentes antivirais.
Os Centros de Controle e Prevenção de Doenças recomendam que as mães infectadas pelo HIV não amamentem seus filhos, a fim de evitar o risco de transmissão do HIV pelo leite materno. Também há evidências de que a estavudina passa para o leite materno animal, embora não existam dados disponíveis para o leite materno humano.
Crianças
A estavudina é segura para uso em crianças infectadas pelo HIV desde o nascimento até a adolescência. Os efeitos adversos e o perfil de segurança são iguais aos dos adultos.
Idoso
Não há dados disponíveis para o uso de estavudina em adultos infectados pelo HIV com 65 anos ou mais. No entanto, entre 12.000 pessoas com mais de 65 anos, 30% desenvolveram neuropatia periférica . Além disso, como os idosos são mais propensos a ter função renal diminuída, eles têm maior probabilidade de desenvolver efeitos colaterais tóxicos.
Eventos adversos
Efeitos colaterais comuns
- Náusea
- Vômito
- Diarréia
- Dor de cabeça
- Estômago virado
Efeitos colaterais graves
- Neuropatia periférica
- Acidose láctica
- Pancreatite
- Hepatotoxicidade
- Hepatomegalia com esteatose
- Lipoatrofia / lipodistrofia (redistribuição / acumulação de gordura)
Os indivíduos são monitorados quanto ao desenvolvimento desses efeitos adversos graves. O desenvolvimento de neuropatia periférica está relacionado à dose e pode ser resolvido se o medicamento for descontinuado. Indivíduos com doença avançada por HIV-1, uma história de neuropatia periférica ou indivíduos em uso de outros medicamentos que tenham associação com neuropatia desenvolvem esse efeito colateral com mais frequência.
A estavudina demonstrou em testes de laboratório ser genotóxica , mas com doses clínicas seus efeitos carcinogênicos são inexistentes. Hiperlactatemia, perda de densidade mineral óssea (DMO), redução da gordura dos membros e aumento dos triglicerídeos foram encontrados quando administrados em altas dosagens. É também um dos antivirais mais prováveis de causar lipodistrofia e, por isso, não é mais considerado um tratamento adequado para a maioria dos pacientes em países desenvolvidos.
O HLA-B * 4001 pode ser usado como um marcador genético para prever quais pacientes desenvolverão lipodistrofia associada à estavudina, para evitar ou encurtar a duração da estavudina, de acordo com um estudo na Tailândia.
Ele ainda é usado como primeira escolha na terapia de primeira linha em locais com poucos recursos, como na Índia. Somente em caso de desenvolvimento de neuropatia periférica ou gravidez é alterado para a próxima escolha, zidovudina . A segurança e eficácia da titulação da dosagem não foram relatadas em pacientes virgens de tratamento. Foi relatado apenas em pacientes com supressão virológica sustentada. Esses achados não são generalizados para a estavudina usada em pacientes virgens de tratamento com altas cargas virais.
Na segunda-feira, 30 de novembro de 2009, a Organização Mundial da Saúde declarou que "[A OMS] recomenda que os países eliminem o uso de Estavudina, ou d4T, por causa de seus efeitos colaterais irreversíveis de longo prazo. A estavudina ainda é amplamente usada em primeiros terapia de linha em países em desenvolvimento devido ao seu baixo custo e ampla disponibilidade. Zidovudina (AZT) ou tenofovir (TDF) são recomendados como alternativas menos tóxicas e igualmente eficazes. "
Mecanismo de ação
A estavudina é um análogo de nucleosídeo da timidina . É fosforilado por quinases celulares em um trifosfato ativo. O trifosfato de estavudina inibe a transcriptase reversa do HIV ao competir com o substrato natural, o trifosfato de timidina . A transcriptase reversa é a enzima que o vírus usa para fazer uma cópia do DNA de seu RNA a fim de inserir seu material genético no DNA do hospedeiro. Após a incorporação na fita de DNA, o trifosfato de estavudina causa o término da replicação do DNA .
Farmacocinética
Absorção: a estavudina tem rápida absorção e boa biodisponibilidade oral (F = 0,86).
Distribuição: A estavudina não se liga às proteínas do sangue.
Metabolismo: a depuração da estavudina é minimamente afetada pelo metabolismo hepático. A oxidação e a glucuronidação produzem metabólitos menores.
Eliminação: a estavudina é eliminada principalmente na urina e principalmente na sua forma inalterada.
Interações medicamentosas
O uso simultâneo de zidovudina não é recomendado, pois pode inibir a fosforilação intracelular da estavudina. Outros medicamentos anti-HIV não possuem essa propriedade.
A estavudina não se liga às proteínas nem inibe as principais isoformas do citocromo P450. Assim, são improváveis interações medicamentosas significativas com medicamentos metabolizados por meio dessas vias ou medicamentos que se ligam a proteínas.
História
Stavudine foi criado por Jerome Horwitz na década de 1960 e foi originalmente denominado D4T. Quando a epidemia de AIDS ocorreu na década de 1980, William Prusoff e o Dr. Tai-Shun Lin descobriram as propriedades anti-HIV da estavudina. A empresa farmacêutica Bristol-Myers Squibb fabrica o medicamento com o nome comercial de Zerit.
É também o primeiro medicamento a receber o status de via paralela em 1992, pela Food and Drug Administration (FDA) dos Estados Unidos , o que permitiu que a agência disponibilizasse a estavudina aos pacientes antes de ser aprovada. A estavudina foi submetida ao processo de aprovação acelerado do FDA. Por meio desse processo, a eficácia da estavudina foi medida por seu efeito no marcador substituto , CD4 , em vez de desfechos clínicos. O FDA concluiu que um aumento na contagem de células CD4 era um indicador de quão eficaz a droga seria contra a AIDS e a infecção pelo HIV. A estavudina foi o quarto medicamento a ser aprovado para o tratamento da AIDS e da infecção pelo HIV pelo FDA em 27 de junho de 1994. Mesmo após a aprovação, os estudos continuaram para avaliar o benefício clínico do medicamento. Se não houver indicação de benefícios clínicos, a aprovação acelerada pode ser retirada.
Em 2018, a Mylan Pharmaceuticals interrompeu a fabricação de cápsulas de 20 mg, 30 mg e 40 mg de estavudina.
Referências
links externos
- "Stavudine" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
