Cenobamato - Cenobamate
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Xcopri, Ontozry |
| Outros nomes | YKP3089 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a620021 |
| Dados de licença | |
| Vias de administração |
Pela boca |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Biodisponibilidade | ≥88% |
| Ligação proteica | 60% |
| Metabolismo | Principalmente glucuronidação via UGT2B7 |
| Meia-vida de eliminação | 50-60 horas |
| Excreção | Principalmente pela urina |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| PubChem SID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Dados químicos e físicos | |
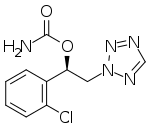
| Fórmula | C 10 H 10 Cl N 5 O 2 |
| Massa molar | 267,67 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
O Cenobamate , vendido sob as marcas Xcopri (EUA) e Ontozry (UE), é um medicamento usado no tratamento de crises epiléticas parciais , uma espécie de epilepsia , em adultos. É tomado por via oral.
O Cenobamato foi aprovado para uso médico nos Estados Unidos em novembro de 2019 e incluído no Anexo V da Lei de Substâncias Controladas em março de 2020. O Cenobamato foi aprovado para uso médico na União Europeia em março de 2021.
Usos médicos
Nos Estados Unidos, o cenobamato é indicado para o tratamento de convulsões parciais em adultos.
Na União Europeia, é indicado para o tratamento adjuvante de crises de início focal com ou sem generalização secundária em adultos com epilepsia que não foram adequadamente controlados, apesar de uma história de tratamento com pelo menos dois medicamentos antiepilépticos.
Contra-indicações
Cenobamato encurta o intervalo QT do ritmo cardíaco. Portanto, é contra-indicado em pessoas com síndrome do QT curto familiar , uma doença muito rara do sistema elétrico do coração.
Efeitos adversos
Os efeitos colaterais mais comuns são sonolência (em 37% das pessoas que tomam o medicamento), tontura (33%) e fadiga (24%). Distúrbios da visão, dor de cabeça e hipercalemia (altos níveis de potássio no sangue) também são comuns. Hipersensibilidade ocorre em menos de 1% dos pacientes, reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) em menos de 0,1%.
Overdose
Existem poucos dados sobre a overdose de cenobamato. Espera-se que ocorram os efeitos adversos descritos como sonolência, tontura e fadiga, bem como, possivelmente, problemas no ritmo cardíaco. Nenhum antídoto específico existe.
Interações
O uso de cenobamato junto com outros depressores do sistema nervoso central , como barbitúricos , benzodiazepínicos ou álcool, pode resultar em aumento da sonolência e outros sintomas do sistema nervoso central .
O cenobamato induz as enzimas CYP3A4 e CYP2B6 e pode, portanto, diminuir as concentrações sanguíneas de medicamentos que são metabolizados por essas enzimas (por exemplo, midazolam e bupropiona , respectivamente). Por outro lado, ele inibe a enzima CYP2C19 , aumentando potencialmente as concentrações de drogas metabolizadas por essa enzima (por exemplo, omeprazol ).
Farmacologia
Mecanismo de ação
Cenobamate é um canal de sódio regulado pela voltagem (VGSC) bloqueador . É um bloqueador seletivo do estado inativado dos VGSCs, inibindo preferencialmente a corrente persistente de sódio. Foi proposto que o cenobamato aumenta adicionalmente a liberação pré-sináptica de ácido γ-aminobutírico (GABA), aumentando assim a neurotransmissão GABAérgica inibitória .
Farmacocinética
O cenobamato é absorvido pelo intestino em pelo menos 88% e atinge as concentrações mais altas no plasma sanguíneo após uma a quatro horas. Quando na corrente sanguínea, 60% da substância se liga às proteínas plasmáticas , principalmente à albumina . O cenobamato é inativado principalmente por glucuronidação através da enzima UGT2B7 e em menor grau UGT2B4 . As enzimas CYP2E1 , CYP2A6 , CYP2B6 , CYP2C19 e CYP3A4 desempenham papéis menores no metabolismo da droga.
As condições de estado estacionário são alcançadas após 14 dias. O cenobamato e seus metabólitos são eliminados principalmente pela urina e apenas 5,2% pelas fezes. A meia-vida terminal é de 50 a 60 horas.
História
A segurança e eficácia do cenobamato no tratamento de convulsões parciais foram estabelecidas em dois estudos randomizados, duplo-cegos e controlados por placebo que envolveram 655 adultos. Nestes estudos, os pacientes tiveram crises parciais com ou sem generalização secundária por uma média de aproximadamente 24 anos e frequência média das crises de 8,5 crises por 28 dias durante um período inicial de 8 semanas. Durante os testes, doses de 100, 200 e 400 miligramas (mg) por dia reduziram o número de convulsões por 28 dias em comparação com o grupo de placebo.
Sociedade e cultura
Status legal
A Food and Drug Administration (FDA) dos EUA aprovou o cenobamato em novembro de 2019 e concedeu o pedido de Xcopri à SK Life Science Inc.
Em 28 de janeiro de 2021, o Comité dos Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos (EMA) adoptou um parecer favorável, recomendando a concessão de uma autorização de introdução no mercado. O requerente para este medicamento é o Arvelle Therapeutics Netherlands BV. Ontozry foi aprovado em 26 de março de 2021.
Referências
links externos
- "Cenobamato" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA (NLM).
