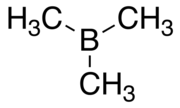
Trimetilborano - Trimethylborane
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Trimetilborano |
|||
| Outros nomes
Trimetilborina
Trimetilboron |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100,008,926 |
||
| Número EC | |||
|
PubChem CID
|
|||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 3 H 9 B | |||
| Massa molar | 55,92 g / mol | ||
| Aparência | Gás ou líquido incolor | ||
| Densidade | 0,625 g / cm 3 a -100 ° C | ||
| Ponto de fusão | −161,5 ° C (−258,7 ° F; 111,6 K) | ||
| Ponto de ebulição | −20,2 ° C (−4,4 ° F; 253,0 K) | ||
| Ligeiro, altamente reativo | |||
| Estrutura | |||
| Δ | |||
| Perigos | |||
| Riscos principais | Espontaneamente inflamável ao ar; causa queimaduras | ||
| Pictogramas GHS |
  
|
||
| Palavra-sinal GHS | Perigo | ||
| H220 , H250 , H280 , H314 | |||
| P210 , P222 , P260 , P264 , P280 , P301 + 330 + 331 , P302 + 334 , P303 + 361 + 353 , P304 + 340 , P305 + 351 + 338 , P310 , P321 , P363 , P370 + 378 , P377 , P381 , P403 , P405 , P410 + 403 , P422 , P501 | |||
| Ponto de inflamação | Não aplicável, gás pirofórico | ||
| −40 ° C (−40 ° F; 233 K) | |||
| Compostos relacionados | |||
|
Compostos relacionados
|
|||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
Trimetilborano (TMB) é um gás pirofórico tóxico com a fórmula B (CH 3 ) 3 (que também pode ser escrito como Me 3 B, com Me representando metil ).
Propriedades
Como líquido, é incolor. A linha mais forte no espectro infravermelho está em 1330 cm −1 seguida por linhas em 3010 cm −1 e 1185 cm −1 .
Seu ponto de fusão é −161,5 ° C e seu ponto de ebulição é −20,2 ° C.
A pressão de vapor é dada por log P = 6,1385 + 1,75 log T - 1393,3 / T - 0,007735 T , onde T é a temperatura em kelvins . O peso molecular é 55,914. O calor de vaporização é 25,6 kJ / mol.
Preparação
O trimetilborano foi descrito pela primeira vez em 1862 por Edward Frankland , que também mencionou seu aduto com amônia. Devido à sua natureza perigosa, o composto não foi mais estudado até 1921, quando Alfred Stock e Friedrich Zeidler aproveitaram a reação entre o gás tricloreto de boro e o dimetilzinco . Embora a substância possa ser preparada com reagentes de Grignard, a saída está contaminada por produtos indesejados do solvente. O trimetilborano pode ser feito em pequena escala com um rendimento de 98% pela reação de trimetilalumínio em hexano com tribrometo de boro em éter dibutílico como solvente. Ainda outros métodos são reagir tributil borato com cloreto de trimetilalumínio, ou tetrafluoroborato de potássio com trimetilalumínio. Ainda outro método é adicionar trifluoreto de boro em éter ao iodeto de metilmagnésio .
Reações
O trimetilborano se inflama espontaneamente no ar se a concentração for alta o suficiente. Ele queima com uma chama verde que produz fuligem. A oxidação mais lenta com oxigênio em um solvente ou na fase gasosa pode produzir dimetiltrioxadiboralano, que contém um anel de dois boro e três átomos de oxigênio. No entanto, o principal produto é o peróxido de dimetilborilmetil, que se decompõe rapidamente em dimetoximetilborano.
O trimetilborano é um ácido de Lewis forte . B (CH 3 ) 3 pode formar um aduto com amônia : (NH 3 ): B (CH 3 ) 3 . bem como outras bases de Lewis. As propriedades do ácido de Lewis de B (CH 3 ) 3 foram analisadas pelo modelo ECW produzindo E A = 2,90 e C A = 3,60. Quando o trimetilborano forma um aduto com a trimetilamina , ocorre a repulsão estérica entre os grupos metila nos resultados B e N. O modelo ECW pode fornecer uma medida desse efeito estérico.
O trimetilborano reage com água e cloro à temperatura ambiente. Ele também reage com a graxa, mas não com Teflon ou vidro.
Trimetilborano reage com diborano para desproporcional para formar monometildiborano e dimetildiborano : (CH 3 ) BH 2 .BH 3 e (CH 3 ) 2 BH.BH 3 .
Ele reage como um gás com a trimetilfosfina para formar um sal de Lewis sólido com um calor de formação de −41 kcal por mol. Este aduto tem um calor de sublimação de −24,6 kcal / mol. Nenhuma reação ocorre com trimetilarsina ou trimetilstibina .
Metil lítio reagindo com o Trimetilborano produz um sal tetrametilborato: LiB (CH 3 ) 4 . O íon tetrametilborato tem carga negativa e é isoeletrônico com neopentano , tetrametilsilano e o cátion tetrametilamônio .
Usar
O trimetilborano tem sido usado como contador de nêutrons. Para tal, tem de ser muito puro. Também é usado na deposição química de vapor, onde o boro e o carbono precisam ser depositados juntos.