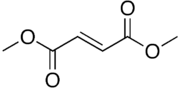
Fumarato de dimetila - Dimethyl fumarate
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
Dimetil ( 2E ) -but-2-enedioato |
|
| Outros nomes
Éster dimetílico do ácido trans -1,2-etilenodicarboxílico
( E ) -2-éster dimetílico do ácido butenodioico |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard |
100,009.863 |
| Número EC | |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 6 H 8 O 4 | |
| Massa molar | 144,126 g · mol −1 |
| Aparência | Sólido cristalino branco |
| Densidade | 1,37 g / cm 3 |
| Ponto de fusão | 103,5 ° C (218,3 ° F; 376,6 K) |
| Ponto de ebulição | 193 ° C (379 ° F; 466 K) |
| Farmacologia | |
| L04AX07 ( OMS ) | |
| Dados de licença | |
| Status legal | |
| Perigos | |
| Pictogramas GHS |

|
| Palavra-sinal GHS | Aviso |
| H312 , H315 , H317 , H319 , H335 | |
| P261 , P264 , P271 , P272 , P280 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P322 , P332 + 313 , P333 + 313 , P337 + 313 , P362 , P363 , P403 + 233 , P405 , P501 | |
| Compostos relacionados | |
|
Diésteres relacionados
|
Dietil fumarato , dimetilo maleato , malonato de dimetilo , adipato de dimetilo |
|
Compostos relacionados
|
Acrilato de metila de ácido fumárico |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O fumarato de dimetila ( DMF ) é o éster metílico do ácido fumárico e tem o nome da planta de fumaça de terra ( Fumaria officinalis ). DMF combinado com três outros ésteres de ácido fumárico (FAEs) é licenciado exclusivamente na Alemanha como uma terapia oral para psoríase (nome comercial Fumaderm ). Desde 2013, foi aprovado pela Food and Drug Administration (FDA) dos EUA como uma opção de tratamento para adultos com esclerose múltipla recorrente (nome comercial Tecfidera ). Em 2017, uma nova formulação oral de DMF (nome comercial Skilarence) foi aprovada pela Agência Europeia de Medicamentos (EMA) para uso na Europa como tratamento para psoríase em placas moderada a grave. Acredita-se que o DMF tenha propriedades imunomoduladoras sem causar imunossupressão significativa .
O DMF também tem sido aplicado como biocida em móveis ou sapatos para evitar o surgimento de mofo durante o armazenamento ou transporte em climas úmidos. No entanto, devido a casos de reações alérgicas após o contato com a pele, produtos de consumo contendo DMF não estão mais autorizados a serem fabricados (desde 1998) ou importados (desde 2009) na União Europeia . O fumarato de dimetila foi aprovado como medicamento genérico nos Estados Unidos em 2020.
Usos médicos
Na Alemanha, o DMF é comercializado para o tratamento da psoríase e está disponível como uma formulação oral misturada com compostos relacionados (Fumaderm); no Reino Unido, está disponível como uma formulação oral pura (Skilarence). Também está disponível nos EUA como uma formulação oral (Tecfidera) para tratar adultos com esclerose múltipla recorrente.
Para o tratamento da psoríase, o DMF é administrado em comprimidos de 30 mg e 120 mg, sendo a dose diária máxima de 720 mg. Para a esclerose múltipla, as doses são de 120 mg e 240 mg, com dose máxima diária de 480 mg. Uma revisão sistemática da Cochrane de 2015 encontrou evidências de qualidade moderada de uma redução no número de pessoas com EM recorrente-remitente que tiveram recaídas ao longo de um período de tratamento de dois anos com DMF versus placebo, bem como evidências de baixa qualidade de redução no agravamento da deficiência, e uma necessidade geral de estudos de maior qualidade com acompanhamento mais longo.
Em março de 2021, o DMF está sendo avaliado como um tratamento para COVID-19 como parte do estudo RECOVERY no Reino Unido.
História
O primeiro uso médico do ácido fumárico foi descrito em 1959 por Walter Schweckendiek, um químico alemão, e era uma formulação tópica para psoríase. A empresa suíça Fumapharm finalmente trouxe o Fumaderm, uma formulação oral de DMF (junto com alguns monoésteres) para o mercado de psoríase na Alemanha em 1994.
Com base na eficácia e segurança desta formulação, e evidências de que DMF era o principal componente ativo, uma formulação oral de DMF foi desenvolvida pela Almirall. Esta formulação oral, sob a marca Skilarence, foi aprovada na Europa pela EMA em junho de 2017 para o tratamento de psoríase em placas moderada a grave em adultos.
A pesquisa clínica inicial sobre o uso de DMF para o tratamento da esclerose múltipla foi conduzida pela Fumapharm em colaboração com a Biogen Idec ; A Fumapharm foi posteriormente adquirida pela Biogen Idec em 2006. A Aditech Pharma na Suécia também pesquisou formulações orais de DMF para MS e, em 2010, a empresa dinamarquesa Forward Pharma adquiriu as patentes da Aditech.
A Biogen continuou desenvolvendo sua formulação oral de DMF da Fumapharm sob o nome de código BG-12; foi aprovado, sob o nome comercial de Tecfidera, para o tratamento de adultos com formas recorrentes de EM em março de 2013. A Biogen fixou o preço do medicamento em US $ 54.000 por ano nos Estados Unidos. Foi aprovado na Europa em 2014. No Reino Unido, o NICE emitiu orientações recomendando o medicamento como custo-efetivo, mas apenas para pacientes que não têm esclerose múltipla grave recorrente-remitente grave altamente ativa ou de evolução rápida e somente se a Biogen concordar em fornecê-lo em um desconto.
A Forward e a Biogen entraram em litígios de patentes em muitas jurisdições; em 2017 as empresas resolveram o litígio, com a Biogen pagando Forward $ 1,25 bilhão, com potencial para até 10% dos royalties dependendo do que acontecesse com as patentes em várias jurisdições.
Em junho de 2020, em um caso entre a Biogen e a Mylan , o Tribunal Distrital dos EUA em West Virginia declarou inválida a chamada patente “514” da Biogen que protegia a Tecfidera da concorrência de genéricos. A decisão deu a Mylan o direito de lançar sua própria versão do Tecfidera dentro de alguns dias, embora a Biogen planejasse entrar com um recurso.
Farmacologia
O fumarato de dimetila é uma molécula lipofílica altamente móvel no tecido humano. Como um composto eletrofílico α, β-insaturado , o DMF é rapidamente atacado pelo agente desintoxicante glutationa (GSH) em uma reação de adição de Michael . Por meio dessas reações, é metabolizado em fumarato de monometila (MMF) antes de entrar na distribuição sistêmica. DMF foi descrito como um pró - fármaco .
DMF é um precursor do fumarato de monometila . Outros pró-fármacos que metabolizam em fumarato de monometila foram desenvolvidos para tratar a esclerose múltipla com remissão de recidiva, incluindo fumarato de diroximel, que foi aprovado pelo FDA em outubro de 2019.
O mecanismo preciso de ação do DMF não está claro. O DMF e o MMF podem ativar a via do fator 2 relacionado ao fator de transcrição ( fator nuclear derivado de eritróide 2) ( Nrf2 ) e o MMF foi identificado como um agonista do receptor de ácido nicotínico in vitro. Em camundongos sem expressão de Nrf2, entretanto, o DMF ainda é capaz de modular o sistema imunológico, o que indica que o Nrf2 não é necessário para sua ação imunomoduladora. Para a psoríase, acredita-se que o mecanismo de ação seja devido à interação do MMF e a redução da glutationa intracelular das células diretamente envolvidas na patogênese da psoríase. A interação com a glutationa leva à inibição da translocação nuclear e da atividade transcricional do fator nuclear kappa-light-chain-enhancer das células B ativadas (NF-κB).
Mais recentemente, o DMF e o MMF mostraram reduzir a expressão do micro-RNA-21, que é essencial para a produção de células patogênicas na esclerose múltipla e na psoríase. Isso pode ser alcançado porque o DMF e o MMF, como metabólitos permeáveis às células, podem regular epigeneticamente a expressão do micro-RNA-21 por meio da interação metabólico-epigenética no desenvolvimento de células imunes.
A atividade principal de DMF e MMF é considerada imunomoduladora, resultando em uma mudança nas células T auxiliares (Th) do perfil Th1 e Th17 para um fenótipo Th2. A produção de citocinas inflamatórias é reduzida pela indução de eventos pró-apoptóticos, inibição da proliferação de queratinócitos, expressão reduzida de moléculas de adesão e infiltrado inflamatório diminuído nas placas psoriáticas.
A principal via de eliminação é a exalação de CO 2 , com pequenas quantidades excretadas pela urina ou fezes.
Não há evidência de interação do DMF com o citocromo P450 e os transportadores de efluxo e absorção mais comuns e, portanto, não são esperadas interações com medicamentos metabolizados ou transportados por esses sistemas.
Síntese e reações
Existem vários métodos para a síntese laboratorial de DMF, com métodos relatados incluindo isomerização de alqueno de maleato de dimetila e esterificação de Fischer de ácido fumárico .
O fumarato de dimetila é um composto antigo usado na química industrial e pode ser comprado por tonelada; em 2012, era possível comprá-lo por US $ 1 a US $ 50 por tonelada métrica, com uma compra mínima de duas toneladas.
O composto sofre eletrohidrodimerização.
Efeitos adversos
No tratamento da psoríase, os eventos adversos mais comuns são eventos gastrointestinais, rubor e linfopenia, que geralmente são leves. Outros eventos adversos incluem leucoencefalopatia multifocal progressiva (PML) e síndrome de Fanconi, que são considerados raros. A PML é provavelmente causada por uma combinação de fatores. Uma infecção anterior com o vírus John-Cunningham (JCV) é considerada um pré-requisito para o desenvolvimento de PML. Em uma revisão de PML, todos os casos confirmados foram de pacientes expostos a períodos de linfopenia variável.
Para a esclerose múltipla, os efeitos adversos incluem rubor e eventos gastrointestinais, como diarreia, náusea e dor abdominal superior. O rótulo do medicamento inclui advertências sobre o risco de anafilaxia e angioedema, PML, linfopenia e danos ao fígado .
Não há informações sobre como o DMF afeta o feto durante a gravidez; em testes com animais, houve dano fetal em doses clinicamente relevantes.
Produtos de consumo
Houve casos de dermatite de contato grave, provavelmente relacionada a uma alergia de contato ao fumarato de dimetila em sofás e cadeiras recém-adquiridos. Verificou-se que o fumarato de dimetila é um sensibilizador alérgico em concentrações muito baixas, produzindo eczema por alergia de contato difícil de tratar. Concentrações tão baixas quanto 1 ppm (partes por milhão) podem produzir reações alérgicas nos casos mais graves. Existe apenas um punhado de sensibilizadores igualmente potentes.
O risco sensibilizante foi trazido à atenção do público pelo incidente da "cadeira envenenada", onde o fabricante chinês Linkwise produziu sofás de dois lugares com sachês de DMF dentro para inibir o mofo enquanto estavam armazenados ou transportados. Na Finlândia, onde as cadeiras foram vendidas de 2006 a 2007, 60 usuários tiveram erupções cutâneas graves. A causa foi identificada como reação alérgica induzida por DMF por Tapio Rantanen da Finlândia e seu artigo original se tornou a matéria de capa na edição de julho de 2008 do British Journal of Dermatology . No Reino Unido, sofás vendidos pela Argos , Land of Leather e Walmsley Furnishing contendo o produto químico causaram mais de uma centena de feridos. Argos retirou os sofás das lojas e contatou os compradores para recolher os que haviam sido vendidos - com o Land of Leather retirando os sofás sem notificar os compradores e Walmsley dizendo que retirou os sachês dos sofás que venderam depois que o perigo veio à tona. O perigo chamou a atenção do público em 2008, quando o programa BBC Watchdog alertou os consumidores sobre os sofás.
Na União Europeia , o uso de DMF na fabricação de produtos de consumo está proibido desde 1998 e, em 2009, a importação de produtos de consumo contendo DMF também foi proibida. A Decisão da Comissão da UE 2009/251, de 17 de março de 2009, exigia que os Estados-Membros garantissem que os produtos de consumo contendo DMF não fossem colocados ou disponibilizados no mercado a partir de 1º de maio de 2009. Isso proibiu definitivamente qualquer comercialização de produtos de consumo contendo DMF na União Europeia. A proibição do DMF prevista na Decisão 2009/251 estabelece uma concentração máxima de DMF nos produtos de 0,1 ppm. A decisão determinou que os produtos de consumo contendo mais de 0,1 ppm de DMF deveriam ser retirados do mercado e retirados dos consumidores.
Veja também
Referências
links externos
- "Fumarato de dimetilo" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- fishersci.ca: Folha de dados de segurança de fumarato de dimetila (MSDS)
