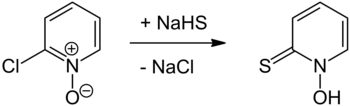Piritiona - Pyrithione
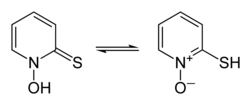 A interconversão de tautômeros de piritiona
forma de tiona à esquerda, forma de tiol à direita |
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
1-Hidroxi-2 (1 H ) -piridinotiona (tiona) 2-piridinotiol 1-óxido (tiol) |
|
| Outros nomes
Omadina
tiona : 1-hidroxipiridina-2-tiona N -Hydroxypyridine-2-tiona tiol : 2-mercaptopiridina monóxido de 2-mercaptopiridina, N -óxido de 2-mercaptopiridina, 1-óxido de |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard |
100.013.027 |
|
PubChem CID
|
|
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 5 H 5 N O S | |
| Massa molar | 127,16 g · mol −1 |
| Aparência | Pó cristalino bege |
| Ponto de fusão | 70 a 73 ° C (158 a 163 ° F; 343 a 346 K) |
| 2,5 g L -1 a 20 ° C | |
| Solubilidade |
Solúvel : benzeno , clorofórmio , diclorometano , dimetilformamida , dimetilsulfóxido , acetato de etila Levemente solúvel : éter dietílico , etanol , éter metil terc- butílico , tetrahidrofurano |
| Acidez (p K a ) | -1,95, 4,6 |
| Perigos | |
| Frases R (desatualizado) | R20 / 21/22 , R36 / 37/38 , R63 |
| Frases S (desatualizado) | S22 , S24 / 25 , S26 , S36 / 37 |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
Piritiona é o nome comum de um composto organossulfurado com fórmula molecular C
5H
5NOS , escolhida como uma abreviatura de piridinetione e encontrada na chalota persa . Existe como um par de tautômeros , sendo a forma principal a tiona 1-hidroxi-2 ( 1H ) -piridinetiona e a forma secundária sendo o tiol 2-mercaptopiridina N- óxido ; ele se cristaliza na forma de tiona. É geralmente preparado a partir de 2-bromopiridina , 2-cloropiridina ou N- óxido de 2-cloropiridina e está comercialmente disponível como composto neutro e seu sal de sódio . É usado para preparar piritiona de zinco , que é usada principalmente para tratar caspa e dermatite seborreica em xampus medicamentosos , embora também seja um agente anti-incrustante em tintas.
Preparação
A preparação da piritiona foi relatada pela primeira vez em 1950 por Shaw e foi preparada pela reação de 2-cloropiridina N- óxido com hidrossulfeto de sódio seguido por acidificação, ou mais recentemente com sulfeto de sódio . O próprio N- óxido de 2-cloropiridina pode ser preparado a partir de 2-cloropiridina usando ácido peracético . Outra abordagem envolve o tratamento do mesmo N- óxido de partida com tioureia para proporcionar N- óxido de cloreto de piridil-2-isotiourônio que sofre hidrólise básica em piritiona. A 2-bromopiridina pode ser oxidada ao seu N- óxido usando um perácido adequado (de acordo com a 2-cloropiridina), sendo ambas as abordagens análogas às relatadas em Organic Syntheses para a oxidação da piridina ao seu N- óxido. Uma reação de substituição usando ditionito de sódio ( Na
2S
2O
4) ou sulfeto de sódio com hidróxido de sódio permitirá a substituição do substituinte bromo por um grupo funcional tiol .
A estratégia alternativa é formar o mercaptano antes de introduzir a porção N- óxido . A 2-mercaptopiridina foi originalmente sintetizada em 1931 pelo aquecimento da 2-cloropiridina com hidrossulfeto de cálcio , uma abordagem semelhante à usada pela primeira vez para preparar a piritiona. A abordagem análoga da tioureia por meio de um sal de urônio foi relatada em 1958 e fornece uma rota mais conveniente para a 2-mercaptopiridina. A oxidação em N- óxido pode então ser realizada.
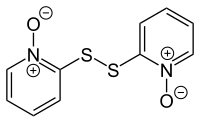
A piritiona é encontrada como um produto natural na planta Allium stipitatum , uma espécie asiática de cebola , também conhecida como chalota persa. Sua presença foi detectada usando espectrometria de massa de íons positivos usando uma fonte de íons DART e o dissulfeto dipiritiona (2,2'-dissulfanodiilbis (piridina) -1,1'-dióxido) foi relatado na mesma espécie. A dipiritiona pode ser preparada em laboratório por oxidação da piritiona com cloro na presença de hidróxido de sódio :
- 2 C
5H
4NOSH + Cl
2 + 2 NaOH → ONC
5H
4–S – S – C
5H
4NO + 2 NaCl + 2 H
2O
- 2 C
A dipiritiona é usada como fungicida e bactericida , e foi relatado que possui uma nova atividade citotóxica por indução de apoptose .
Propriedades
A piritiona existe como um par de protótropos, uma forma de tautomerismo em que a rápida interconversão de isômeros constitucionais envolve o deslocamento de um único próton, neste caso entre os átomos de enxofre e oxigênio (mostrado na infobox acima).
Os sais da base conjugada da piritiona também podem ser considerados como exibindo tautomerismo, associando nocionalmente o íon sódio a qualquer heteroátomo que carregue a carga negativa do ânion (em oposição às cargas formais associadas ao N- óxido); no entanto, considerando apenas o ânion, isso também pode ser descrito como um exemplo de ressonância .
A piritiona é um ácido fraco com valores de p K a de -1,95 e +4,6 (próton tiol), mas é um ácido marcadamente mais forte do que qualquer um de seus compostos originais (piridina- N- óxido e piridina-2-tiol), ambos os quais tem p K a > 8. É apenas ligeiramente solúvel em água (2,5 g L -1 ), mas é solúvel em muitos solventes orgânicos (incluindo benzeno , clorofórmio , diclorometano , dimetilformamida , dimetilsulfóxido e acetato de etila ) e ligeira solubilidade em outros ( éter dietílico , etanol , éter metil- terc- butílico e tetra - hidrofurano ).
A piritiona pode ser usada como fonte de radical hidroxila na síntese orgânica, pois se decompõe fotoquimicamente em radical HO • e (piridin-2-il) sulfanila.
Formulários
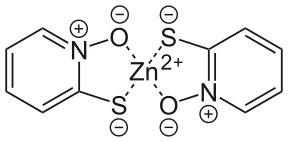
Superior : Fórmula estrutural do monômero
Parte inferior : Modelo de bola e bastão do dímero
A base conjugada de piritionato (íon piritionato) é um ânion contendo dois átomos doadores , um átomo de enxofre e um átomo de oxigênio, cada um carregando uma carga formal negativa ; o átomo de nitrogênio permanece formalmente carregado positivamente. O ânion tiolato pode ser formado por reação com carbonato de sódio e a piritiona de zinco é formada quando o cloreto de zinco é adicionado. O ânion pode atuar como um ligante monodentado ou bidentado e forma um complexo 1: 2 com um centro metálico de zinco (II). A piritiona de zinco tem sido usada desde 1930, embora sua preparação não tenha sido divulgada até uma patente britânica de 1955, na qual a piritiona foi reagida diretamente com sulfato de zinco hidratado em etanol. Em sua forma monomérica , a piritiona de zinco tem dois dos ânions quelados em um centro de zinco com uma geometria tetraédrica . No estado sólido, forma um dímero no qual cada centro de zinco adota uma geometria trigonal bipiramidal com dois dos ânions atuando como ligantes de ligação coordenados através dos átomos de oxigênio nas posições axiais. Em solução, os dímeros se dissociam por meio da cisão das ligações zinco-oxigênio a cada ligante em ponte. A dissociação posterior do monômero em seus constituintes pode ocorrer e é indesejável, pois o complexo é mais potente em aplicações médicas; por esta razão, carbonato de zinco pode ser adicionado às formulações, pois inibe a dissociação do monômero.
A piritiona de zinco tem uma longa história de uso em xampus medicamentosos para tratar caspa e dermatite seborreica (a caspa pode ser considerada uma forma leve de dermatite seborreica). Apresenta propriedades antifúngicas e antimicrobianas , inibindo as leveduras Malassezia que promovem essas condições do couro cabeludo. Os mecanismos pelos quais este trabalho são objeto de estudo contínuo. Ele pode ser usado como um agente antibacteriano contra infecções por Staphylococcus e Streptococcus para doenças como pé de atleta, eczema, psoríase e micose. É conhecido por ser citotóxico contra Pityrosporum ovale , especialmente em combinação com cetoconazol , que é a formulação preferida para dermatite seborreica. A piritiona em si inibe os processos de transporte de membrana em fungos.
As tintas usadas em ambientes externos às vezes incluem piritiona de zinco como um preventivo contra algas e míldio.